
Бонусты жинап картаңызға (kaspi Gold, Halyk bank) шығарып аласыз
Менделеев Клапейрон теңдеуі

УДК 531.13
Т.Б. Қоштыбаев, Ж. Саденова, А. Сейткаримова, Ұ. Сейтжанқызы.
Қазақ ұлттық қыздар педагогикалық университеті, Алматы қ., Қазақстан
МЕНДЕЛЕЕВ‒КЛАПЕЙРОН ТЕҢДЕУІ
Аңдатпа
Бұл мақала идеал газдың энергисын Б.Менделеев және Д.Клапейрон ұстанымдары бойынша анықтау жолдары көрсетілген. Газ күйлерімен қатар изопроцестерде қамтылған. Менделеев-Клапейрон теңдеуі әртүрлі салаларда маңызды рөл атқарады, себебі ол газдардың физикалық қасиеттері мен олардың күйін сипаттайды. Менделеев-Клапейрон теңдеуі идеал газдың қасиеттін қамтиды. Идеал газ заңдары оның ішінде Бойль-Мариотт заңы, Гей-Люссак заңы, Шарль заңы жеке-жеке тоқталып, олардың графиктері мен формулаларын оған қоса тұрақты (T,V,P) параметрлерін нақтылап жаздық. Бұл параметрлерді байланыстыратын теңдеудің газ күйінің теңдеуі екенің көрсеттік. Газ күйінің теңдеуін молекулалы-кинетикалық теорияның негізгі теңдеуін пайдаланып шығардық. Үш идеал газдың әрқайсысына мысалдар келтіріп, газдың күйлерін анықтадық. Газ молекуласының концентрациясын ескеріп, одан газ молекуласының санын газдың зат мөлшері арқылы табамыз. Соның нәтижесінде идеал газ теңдеуін келтірдік. Бұл мақаланың мақсаты идеал газ заңдылықтарын түсіндіру. Газдардың қасиеттерін есептеу кезінде теңдеуді қолдану тәсілдерін меңгеру. Оған қоса мақаладан зертханалық және өндірістік есептерде Менделеев-Клапейрон теңдеуін қолдану мүмкіндігін арттырдық.
Түйін сөздер: Менделеев-Клапейрон, изопроцестер, Бойль-Мариотт, Гей-Люссак, Шарль, параметлер, идел газ, концентрация, зат мөлшері.
Т.Б. Коштыбаев, Ж. Саденова, А. Сейткаримова, У. Сейтжанкызы.
Казахский национальный женский педагогичесий университет, г. Алматы, Казахстан
УРАВНЕНИЕ МЕНДЕЛЕЕВА‒КЛАПЕЙРОНА
Аннотация
Эта статья описывает способы определения энергии идеального газа на основе принципов Б. Менделеева и Д. Клапейрона. В ней рассматриваются состояния газа, а также изопроцессы. Уравнение Менделеева-Клапейрона играет важную роль в различных областях, поскольку описывает физические свойства газа и его состояние. Уравнение охватывает характеристики идеального газа. Законы идеального газа, включая закон Бойля-Мариотта, закон Гей-Люссака и закон Шарля, рассмотрены отдельно с представлением их графиков, формул и уточнением постоянных параметров (T, V, P). Мы показали, что эти параметры связываются уравнением состояния газа.Уравнение состояния газа было выведено с использованием основного уравнения молекулярно-кинетической теории. Для каждого из трёх идеальных газов приведены примеры, позволяющие определить их состояния. Учтена концентрация молекул газа, а также найдено количество молекул газа через количество вещества. В результате выведено уравнение состояния идеального газа. Цель данной статьи — объяснить закономерности, относящиеся к идеальному газу. Она также обучает использованию уравнения при расчёте свойств газов. Кроме того, статья демонстрирует возможности применения уравнения Менделеева-Клапейрона в лабораторных и производственных расчетах.
Ключевые слова: Ключевые слова: Менделеев-Клапейрон, изопроцессы, Бойль-Мариотт, Гей-Люссак, Шарль, параметры, идеальный газ, концентрация, количество вещества.
Koshtybayev T., Sadenova Zh., Seitkarimova А., Seitzhankyzy U.
Kazakh National Women's Teacher Training University, Almaty, Kazakhstan
MENDELEEV‒KLAPEYRON EQUATION
Abstract
This article describes methods for determining the energy of an ideal gas based on the principles of B. Mendeleev and D. Clapeyron. It examines the states of a gas as well as isoprocesses. The Mendeleev-Clapeyron equation plays an important role in various fields, as it describes the physical properties and state of a gas. The equation encompasses the characteristics of an ideal gas. The laws of ideal gases, including Boyle-Mariotte's law, Gay-Lussac's law, and Charles's law, are individually discussed with the presentation of their graphs, formulas, and clarification of constant parameters (T, V, P). We demonstrated that these parameters are interconnected by the equation of state for gases.The equation of state was derived using the fundamental equation of molecular-kinetic theory. Examples are provided for each of the three ideal gases, allowing the determination of their states. The concentration of gas molecules is taken into account, and the number of gas molecules is calculated through the amount of substance. As a result, the equation of state for an ideal gas was derived.The purpose of this article is to explain the laws related to ideal gases. It also teaches the application of the equation in calculating gas properties. Additionally, the article highlights the potential for using the Mendeleev-Clapeyron equation in laboratory and industrial calculations.
Keywords: Mendeleev-Clapeyron, isoprocesses, Boyle-Mariotte, Gay-Lussac, Charles, parameters, ideal gas, concentration, amount of substance.
Кіріспе. Менделеев-Клапейрон теңдеуін «Идеал газ күйінің теңдеуі» деп айтсақта болады. Идеал газ дегеніміз-молекулалары шексіз аз көлем алатын серпімді шариктер болып табылатын және өзара әрекеттесуі тек олардың бір-бірімен тікелей немесе ыдыстың қабырғасымен соқтығысуы кезінде ғана бөлінетін газ болып табылады.Идел газдың ыдыс қабырғасына түсіретін қысымы немесе бұл теңдеу МКТ‒ның негізгі теңдеуі деп аталады. Идеал газ модельі бір молекула, бір моль, бірлік көлем және барлық газ қағидасында жасалған, яғни газды сипаттайтын масса, молекулалар саны, энергия және орташа жылдамдық секілді шамаларды осындай реттілікке қатысты анықтау ұсынылған. Математикалық ақпарат ретінде орташалау және еселеу әдістері қолданылған. Газдың көлемі бірлік көлемдердің жалпы саны деп алынған болса, газдың қасымы бірлік көлемдерде жинақталған энергия ретінде қарастырылған. Бірлік көлемдегі мольдердің саны деген шама енгізіліп, сол арқылы молекулалар концентрациясы мен мольдердің жалпы саны анықталған. Күй параметрлерінің арасындағы арақатынастар энергияның кельвиндік және джоульдік 7 өлшемдері негізінде іске асырылады.

Негізгі бөлім. Бұл теңдеулерді алғаш рет жазған Д. Менделеев пен Б. Клапейрон болғандықтан, оларды идеал газдың күйін сипаттайтын теңдеулер немесе газдың толық энергиясын анықтайтын Менделеев-Клапейрон теңдеулері деп атайды. Газдың қандай күйде тұрғанын білу үшін оның термодинамикалық параметрлерін, яғни қысымды, температураны, көлемді білу қажет. Параметрлердің біреуінің өзгерісі оның басқа параметрлерінің өзгеруіне әкеп соғады. Бұл параметрлерді байланыстыратын теңдеу газ күйінің теңдеуі деп аталады. Осы теңдеуді молекулалы-кинетикалық теорияның негізгі теңдеуін пайдалана отырып, шығарып көрейік. Бізге

екені белгілі. Газ
молекуласының концентрациясы 
 ескеріп,
ескеріп,  аламыз.
Осыдан:
аламыз.
Осыдан:

шығады.Газ молекулаларының санын газдың зат мөлшері арқылы табамыз. Осы айтылғандарды ескерсек, онда идеал газ үшін мына теңдеу орындалады.

Идеал газ
заңдары. Бойль- Мариотт
заңы: бұл заң газдағы изотермдік
процесті сипаттайды. Бойль-Мариотт заңы бойынша, тұрақты
температурада ( const ) газдың белгілі
массасының көлемі оның қысымына кері пропорционал өзгереді,
сондықтан PV=const. Бұл теңдеуді “Изотермия теңдеуі”деп
атайды. Изотермиялық процесс кезінде
газдың температурасы тұрақты және ішкі энергиясы өзгермейді. Газға
берілген барлық жылу мөлшері пайдалы жұмыс жасауға жұмсалады.
Газдың белгілі бір тұрақты температурасында, жылу алған кездегі
және жылу берген кездегі газдың жасаған жұмысы қандай болатындығын
бакылаңыздар. Газға берілген барлық жылу
мөлшері пайдалы жұмыс атқаруға жұмсалады: Q = А . Газ белгілі жылу
мөлшерін ( ) алған кезде, ол оң
жұмыс атқарады (
) алған кезде, ол оң
жұмыс атқарады ( ). Керісінше, егер газ
қоршаған ортаға жылу берсе, онда оның атқарған жұмысы теріс болып
саналады.Изотермиялық процессті жүзеге асыру үшін жүйе, әдетте,
термостатқа орналастырылады. Бұл жағдайда термостаттың жылу
өткізгіштігі өте үлкен болып келеді де, жүйе температурасының іс
жүзінде жүзінде термостат температурасынан айырмашылығы
болмайды.Изотермиялық процесстің мысалына тұрақты температурадағы
сұйыктықтың қайнауы не қатты дененің балқуы жатады. Изотермиялық
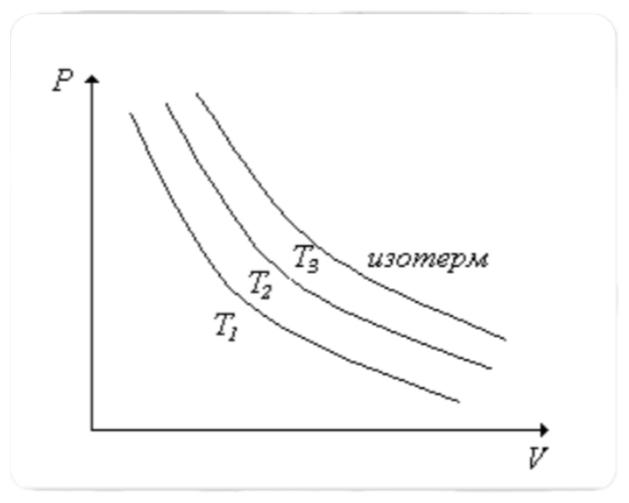
процесс кезіндегі идеал газда қысым мен көлемнің көбейтіндісі
тұрақты болады. Егер V = const болса,
температура жоғарлағанда қысым күй теңдеуіне сәйкес артады.
Сондықтан жоғарлау
). Керісінше, егер газ
қоршаған ортаға жылу берсе, онда оның атқарған жұмысы теріс болып
саналады.Изотермиялық процессті жүзеге асыру үшін жүйе, әдетте,
термостатқа орналастырылады. Бұл жағдайда термостаттың жылу
өткізгіштігі өте үлкен болып келеді де, жүйе температурасының іс
жүзінде жүзінде термостат температурасынан айырмашылығы
болмайды.Изотермиялық процесстің мысалына тұрақты температурадағы
сұйыктықтың қайнауы не қатты дененің балқуы жатады. Изотермиялық
процесс кезіндегі идеал газда қысым мен көлемнің көбейтіндісі
тұрақты болады. Егер V = const болса,
температура жоғарлағанда қысым күй теңдеуіне сәйкес артады.
Сондықтан жоғарлау  температураға сәйкес
изотерма, төменірек
температураға сәйкес
изотерма, төменірек  температураға сәйкес
келетін изотермиядан жоғары жатады. Шынында, бұл жағдайда
температура өзгеретіні рас, алайда алғашқы жуықтауда ондай
өзгерісті елемеуге болады
температураға сәйкес
келетін изотермиядан жоғары жатады. Шынында, бұл жағдайда
температура өзгеретіні рас, алайда алғашқы жуықтауда ондай
өзгерісті елемеуге болады


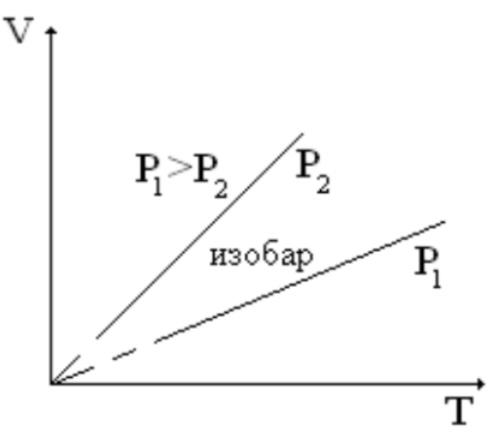
Осы теңдеу изобара теңдеуі деп аталады, ал тұрақты қысымда және физикалық жүйеде өтетін процесті изобарлық процесс дейді. Ол термодинамикалық диаграммада изобарамен кескінделеді.Мысалы: ашық ыдыстағы суды қыздыру, еркін қозғалатын поршені бар цилиндрдегі газдың ұлғаюы жатады. Бұл екі жағдайда да қысым атмосфералық қысымға тең. Изобаралық процесс кезінде идеал газдың көлемі температураға пропорционал болады Изобаралық процессте, жүйенің жылу сыйымдылығы изохоралық процеске (тұрақты көлемде) қарағанда көбірек болады. Мысалы, идеал газ үшін:
 мұндағы
мұндағы  және
және  -
изобаралық және изохоралық
процесстердегі бір бөлшекке келетін жылу сыйымдылықтары. Изобаралық
процессте идеал газдың жасайтын жұмысы:
-
изобаралық және изохоралық
процесстердегі бір бөлшекке келетін жылу сыйымдылықтары. Изобаралық
процессте идеал газдың жасайтын жұмысы:
 ,
мұндағы
P-қысым,
,
мұндағы
P-қысым,  -газ көлемнің
өзгерісі.
-газ көлемнің
өзгерісі.
Шарль заңы: көлемі тұрақты жүйеде өтетін процесс ( V const ) изохоралық процесс. Идеал газ күйінің теңдеуінен изохора теңдеуі былай анықталады:

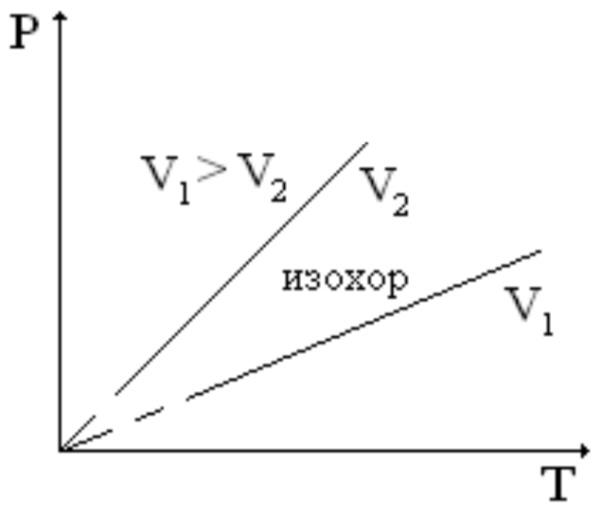
Изохоралык процесс кезінде
газдын көлемі тұрақты және ішкі энергиясының өзгерісі оған берілген
жылу мөлшеріне тең. Газдың белгілі бір тұрақты
көлемінде, жылу алған кездегі және жылу берген кездегі газдың
жасаған жұмысы қандай болатындығын
бақылаңыздар. Бұл процесте газ көлемі
өзгермейді: V = const. Газдың ішкі энергиясының өзгерісі оған
берілген жылу мөлшеріне тең: U=Q. Егер газ ыздырылса,
онда  жэне
жэне  – ішкі энергия ұлғаяды.
Газды суытқан кезде:
– ішкі энергия ұлғаяды.
Газды суытқан кезде:  және
және  , онын ішкі энергиясы
азаяды. Изохоралық процессті көлемі өзгермейтін тұмшаланған
ыдыстағы газдар мен сұйықтықтарда жүзеге асыруға болады. Дене
көлемінің өзгеруіне ішкі энергиясының өзгеруі жылудың жұтылуы не
шығуы есебінен атқарылады. Температураның өзгеруіне байланысты
газдың (сұйықтықтың) кысымы да өзгереді.
, онын ішкі энергиясы
азаяды. Изохоралық процессті көлемі өзгермейтін тұмшаланған
ыдыстағы газдар мен сұйықтықтарда жүзеге асыруға болады. Дене
көлемінің өзгеруіне ішкі энергиясының өзгеруі жылудың жұтылуы не
шығуы есебінен атқарылады. Температураның өзгеруіне байланысты
газдың (сұйықтықтың) кысымы да өзгереді.
|
|
сан |
масса |
энергия |
|
|
|
|
1 молекула |
1 |
|
KT |
|
|
|
|
1 моль |
|
|
RT |
|
|
|
|
|
n |
|
P |
|
V
|
|
|
газ |
N |
m |
W |
|
3VRT |
|
|
|
|
|
|
|
|
|
Қорытынды: Менделеев-Клапейрон теңдеуі идеал газдардың күйін қарапайым түрде сипаттайтын әмбебап құрал болып табылады. Ол газдың қысымы, көлемі, температурасы және зат мөлшері арасындағы тікелей байланысты орнатып, газдармен жұмыс істеуге ыңғайлы негіз болады. Бұл теңдеу тәжірибелік және теориялық есептерде, химиялық реакциялардағы газдардың күйін анықтауда, атмосфералық құбылыстарды модельдеуде кеңінен қолданылады.Менделеев-Клапейрон теңдеуі нақты газдардың мінез-құлқын дәлме-дәл сипаттамаса да, қарапайым есептерде және стандартты жағдайларда (жоғары температура мен төмен қысымда) жақсы нәтиже береді. Оның артықшылығы формуласының қарапайымдылығында және қолдану аясының кеңдігінде. Осылайша, Менделеев-Клапейрон теңдеуі ғылымның көптеген салаларында газдардың күйін түсіну мен зерттеуде маңызды рөл атқарып, практикалық есептерде негізгі құрал ретінде қолданылады. Менделеев-Клапейрон теңдеуі химияда, физикада, инженерияда және атмосфералық құбылыстарда зерттеуде кеңінен қолданылады. Теңдеу нақты газдарға жуықтап қолданылғанымен, ол технологиялық процестерді модельдеу және есептеудің негізін құрайды.
Пайдаланылған әдебиеттер:
1.Гей-Люссак Ж.Л. (1809) . Об отношениях расширений газов и паров, вызванных теплом. Annales de chimie et de physique,68, 187-241
2. Қоштыбаев Т.Б. Физика. Алматы: «KEMEL КІТАР» баспасы, 2024 жыл. 152-165 бет.
3. Д.И.Менделеев. “Основы химии” 1868 жыл. 39 бет.
4. Д.И.Менделеев “О напряжении газов” мақаласы. 1875 жыл
5. Д.В.Сивухин “Термодинамика и молекулярная физика” 2008 жыл, 449 бет
6. Ландау, Л.Д., Лифшиц, Е.М. Статистическая физика. Часть 1.
7. Терехов, А.М. Современная термодинамика для физиков и химиков. 2023жыл. 293 бет
8. Сергеев, К.Н. Курс статистической физики и термодинамики. 2022 жыл. 345 бет
Авторлар туралы мәлімет:
Қоштыбаев Талғат Бектасұлы ‒ ғылыми жетекші, ф.-м.ғ.к., Қазақ ұлттық
қыздар педагогикалық университеті физика
кафедрасының доценті, Алматы қ., Әйтеке би,
99.
Саденова Жансая Ордабайқызы‒Қазақ ұлттық қыздар педагогикалық
университетінің 2‒ші курс студенті. Алматы қ.
Әйтеке би, 99
Сейткаримова Анел Нұрбекқызы ‒ Қазақ ұлттық қыздар педагогикалық
университетінің ‒ 2ші курс студенті,
Алматы қ., Әйтеке би, 99
Сейтжанқызы Ұлдана ‒ Қазақ ұлттық қыздар педагогикалық
университетінің 2‒ші курс студенті Алматы қ.
Әйтеке би, 99





























