ЖАМБЫЛ ОБЛЫСЫ Т.РЫСҚҰЛОВ АУДАНЫ ӘКІМДІГІНІҢ БІЛІМ БӨЛІМІНІҢ
«АҚТОҒАН ОРТА МЕКТЕБІ» КОММУНАЛДЫҚ МЕМЛЕКЕТТІК МЕКЕМЕСІ
«Қаралды» «Келісемін» «Бекітемін»
әдістемелік бірлестік мектеп директорының Ақтоған орта мектебінің
отырысында ----------- ғылыми әдістемелік ісі директоры ӘБ жетекшісі ---------- жөніндегі орынбасары _____О.М.Рыскулова
---------- Абдезова Д.А. _______Дарменова Э.Т
«_____»____2018ж.
«_____»____2018ж. «-----»--------- 2018 ж.
.
Авторская программа
«Основы молекулярной биологии»
Программа курса для 11классов естественно-математического направления
Когершин 2016
Пояснительная записка
Предлагаемый курс раcчитан 34 часа (1 час в неделю), он охватывает основные разделы и «Молекулярной биологии», которые являются одним из самых сложных для понимания в школьном курсе биологии. Курс поддерживает и углубляет базовые знания по биологии и направлен на формирование и развитие основных учебных компетенций и в правильном выборе профессии.
Умение решать задач по молекулярной биологии, генетики развивает
логическое мышление, позволяет учащимся добиваться получения качественных, углубленных знаний, даёт возможность самоконтроля и самовоспитания. Учитывая результаты анализа ЕНТ закрепления материала, который ежегодно вызывает затруднения: это раздел генетики, Химическая организация клетки; обмен веществ и превращение энергии.
Курс дает возможность лучше познать фундаментальные генетические понятия, отражающие строение и функционирование биологических систем на всех уровнях организации жизни. Основы молекулярной биологии позволяет также углубить и закрепить знания по разделам общей биологии, генетики, микробиологии, медицине и эволюционной теорией. Огромную важность в непрерывном образовании приобретают вопросы самостоятельной работы учащихся, умение мыслить самостоятельно и находить решение. самоконтролю и самооценке. Это формирует творческое отношение к труду важное для человека любой профессии и является важным условием успешного, качественного выполнения им своих обязанностей.
Особенностями программы курса является тесная связь его содержания с уроками общей биологии, химии и соответствие Государственного стандарта
Целью данного курса: является развитие у учащихся умений и навыков решения задач по основным разделам молекулярной биологии.
Задачи курса:
- усвоение основных понятий, терминов и законов генетики;
- применение теоретических знаний на практике;
- развитие интереса к предмету;
- ознакомление с практической значимостью общей биологии для различных отраслей производства. Курс позволяет учащимся подготовиться к сдаче ЕНТ.
После прохождения курса учащиеся должны знать
- основные понятия, термины и законы цитологии и генетики;
- значения молекулярной биологии в медицине;
- решать задачи по курсу цитологии и генетики;
- применении микробиологии в медицине:
Оценивание знания учащихся
В процессе обучения курса, знания учащихся оценивается,
выполнением тестовых заданий и контрольных работ.
Критерий оценок:
Высший уровень 18-20 балов
Достаточный уровень 11-17
Удовлетворительный уровень 5-10
Низкий уровень 1-4
Уровень знания учащихся отслеживается годовым и полугодовым мониторингом. Оценивание проводится формативное и суммативное. В процессе обучения оценивание проводится в виде групповых и индивидуальных работ.
Литература:
-
Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
5-9с
-
Красновидова С.С. Дидактические материалы по общей биологии:
10-11 кл.: Пособие для учащихся общеобразовательных учреждений/ С.С Корасновидова, С.А. Павлов, А.Б. Хватов.- М.: Просвещение, 2000.-159 с
3. Ж.Биология,география Алматы 1999№6 32-35с
4. ж.Биолог анықтамалығы Алматы №2. 2011, с 14-17
5. ж.Биолог анықтамалығы Алматы №8. 2011, с 26-29
6 .Настольная книга учителя биологии/ Авт.-сост. Калинова Г.С.,
Кучменко АСТ»: «ООО Издательство Астрель», 2002.-158 с..
7.Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
36-38с
8.Семенцова В.Н. Биология. Общие закономерности. 9 класс.
Технологические карты уроков: Методическое пособие. –
СПб.:»Паритет», 2002.-192 с.
9. Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
10. Козлова Т.А. Тематическое и поурочное планирование по
биологии. К учебнику А.А. Каменского, Е.А. Криксунова, В.В.
Пасечника «Общая биология: 10-11 классы». М.: Изд-во
«Экзамен», 2006. – 286 с
11. Уч.пос. Общая биология 10кл. авт.Т.Касымбаева
К.Мухамбетжанов Алматы"Мектеп" 2010
12. ж.Биолог анықтамалығы Алматы №4. 2011, с 50-55
Дополнительная литература:
13. Методическое пособие к учебнику В.Б. Захарова, Н. И Сонина
«Биология. Общие закономерности. 10 класс / Т.А. Ловкова, Н.И.
Сонин,– М.: Дрофа, 2003.– 128 с.
14. Биология. Человек/ В.Н. Фросин, В.И. Сивоглазов. – М.: Дрофа,
2003
15. Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
65-66с 15. Ж.Биология,география Алматы 2000 №9 42-45с
16. Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
137-139с
17. Кочергин Б. Н., Кочергина Н. А. «Задачи по молекулярной
биологии и генетике» (Минск, «Народная асвета», 1982
18. Муртазин Г. М. «Задачи и упражнения по общей биологии
(Москва, 1981г.)
Ресурсы дистанционного обучения
http://www.informika.ru/- обучающих программ по биологии и химии.
http://testipobiologii.ucoz.ru/ - тесты по биологии от учителя биологии Муромцевой Юлии Владимировны (авторский персональный сайт)
http://www.ballov.net/login.php - тесты на странице электронного дневника ballov.net(авторские ресурсы)
Содержание:
І. раздел Синтез ДНК и теломераза – 16
Этот раздел ознакомит учащихся с компонентами ядра, ядерной оболочкой, эволюционным значением ядра, происхождением ядра, молекулярным механизмом, репликацией основной части ДНКа, репликацией теломерных отделов, механизмом действия теломеразы, механизмы действия теломер в соматических клетках, теломеразы, рака и старения, метилирование ДНК, метилирование ДНК у человека, роль метилирования в онкогенезе, репликация повреждений ДНК, повреждение оснований, преждевременная терминация белковой цепи.
ІІ. раздел Экспрессия генов и транскрипционные факторы 14ч.
Этот раздел ознакомит учащихся с строением и функциями хромасом,
организацией генетического материала способами записи, способами записи генетической информации в молекуле ДНК, биологический код и его свойствами, оперонной организацией генетического материала у бактерий,
конститутивными генами и белками, количественными особенностями генома эукариот,
конститутивными генами и белками, гетерогенность ДНК эукариот по нуклеотидному составу, особенностями репликации эукариотических хромосом, структурой РНК,
синтезем РНК, синтезем ДНК, созреванием РНК, распадом мРНК.
ІІІ. раздел Синтез белков, их фолдинг и модификации. 4ч.
Этот раздел ознакомит учащихся с трансляциями мРНК у прокариот, фолдингом белков, модификацией белков, получением антибиотиков
«Основы молекулярной биологии»
Программа курса для 11классов естественно-математического направления
|
№ |
Тема урока |
Часы |
Сроки |
Практические работы. |
|
|
1. Синтез ДНК и теломераза – 16 |
|
|
|
|
1 |
Компоненты ядра |
1 |
|
|
|
2 |
Ядерная оболочка |
1 |
|
|
|
3 |
Эволюционное значение ядра |
1 |
|
|
|
4 |
Происхождение ядра |
1 |
|
Решение задач |
|
5 |
Молекулярный механизм |
1 |
|
|
|
6 |
Репликация основной части ДНК |
1 |
|
|
|
7 |
Репликация теломерных отделов |
1 |
|
|
|
8 |
Механизм действия теломеразы |
1 |
|
|
|
9 |
Механизмы действия теломер в соматических клетках |
1 |
|
|
|
10 |
Теломераза, рак и старение |
1 |
|
|
|
11 |
Метилирование ДНК |
1 |
|
|
|
12 |
Метилирование ДНК у человека |
1 |
|
|
|
13 |
Роль метилирование в онкогенезе |
1 |
|
Решение задач |
|
14 |
Репликация повреждения ДНК |
1 |
|
Решение задач |
|
15 |
Повреждение оснований |
1 |
|
|
|
16 |
Преждевременная терминация белковой цепи |
|
|
|
|
|
2. Экспрессия генов и транскрипционные факторы 14ч. |
1 |
|
Решение задач |
|
17 |
Строение и функции хромасом |
1 |
|
|
|
18 |
Организация генетического материала способ записи |
1 |
|
|
|
19 |
Способ записи генетической информации в молекуле ДНК. Биологический код и его свойства |
1 |
|
|
|
20 |
Оперонная организация генетического материала у бактерий. |
1 |
|
|
|
21 |
Конститутивные гены и белки |
1 |
|
|
|
22 |
Количественные особенности генома эукариот
|
1 |
|
Решение задач |
|
23 |
Конститутивные гены и белки |
1 |
|
|
|
24 |
Гетерогенность ДНК эукариот по нуклеотидному составу |
1 |
|
|
|
25 |
Особенности репликации эукариотических хромосом |
1 |
|
Решение задач |
|
26 |
Структура РНК |
1 |
|
Решение задач |
|
27 |
Синтез РНК |
1 |
|
Решение задач |
|
28 |
Синтез ДНК |
1 |
|
Решение задач |
|
29 |
Созревание РНК |
1 |
|
|
|
30 |
Распад мРНК |
1 |
|
|
|
|
3. Синтез белков, их фолдинг и модификации. 4ч. |
|
|
|
|
31 |
Трансляция мРНК у прокариот |
1 |
|
|
|
32 |
Фолдинг белков |
1 |
|
|
|
33 |
Модификация белков |
1 |
|
|
|
34 |
Получение антибиотиков |
1 |
|
|
ЖАМБЫЛ ОБЛЫСЫ Т.РЫСҚҰЛОВ АУДАНЫ ӘКІМДІГІНІҢ БІЛІМ БӨЛІМІНІҢ
«АҚТОҒАН ОРТА МЕКТЕБІ» КОММУНАЛДЫҚ МЕМЛЕКЕТТІК МЕКЕМЕСІ
.
«Основы молекулярной биологии»
Методическое руководство
11 класс
Учитель биологии Ахимбекова Айман Несипбаевна
Урок №1
Тема урока Компоненты ядра – 2ч
Цель: развивать и углублять знания по темекомпоненты ядра
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новаятема:
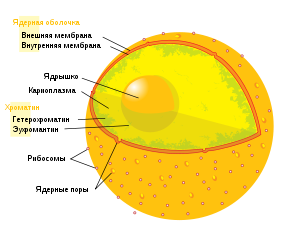
Ядро (лат. nucleus) — это один из структурных компонентов эукариотической клетки, содержащий генетическую
информацию (молекулы ДНК),
осуществляющий основные функции: хранение, передача и реализация
наследственной информации с обеспечением синтеза белка. Ядро состоит
из хромати́на, я́дрышка, кариопла́змы(или нуклеоплазмы)
и ядерной оболочки. В клеточном ядре
происходит репликация (или редуплика́ция) —
удвоение молекул ДНК, а также транскрипция —
синтез молекул РНК на молекуле
ДНК. Синтезированные в ядре молекулы РНК модифицируются, после чего
выходят в цитоплазму. Образование обеих
субъединиц рибосом происходит в специальных
образованиях клеточного ядра — ядрышках. Таким образом, ядро клетки
является не только вместилищем генетической информации, но и
местом, где этот материал функционирует и воспроизводится.
Тонкая структура клеточного ядра
Схема строения клеточного ядра.
Хроматин
Огромная длина молекул ДНК эукариот предопределила появление специальных механизмов хранения, репликации и реализации генетического материала. Хроматином называют молекулы хромосомной ДНК в комплексе со специфическими белками, необходимыми для осуществления этих процессов. Основную массу составляют «белки хранения», так называемые гистоны. Из этих белков построены нуклеосомы — структуры, на которые намотаны нити молекул ДНК. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырёх типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь белков. Гистон H1, более крупный чем другие гистоны, связывается с ДНК в месте её входа на нуклеосому. Нуклеосома вместе с H1 называется хроматосомой.
Схема, показывающая цитоплазму, вместе с её компонентами
(или органеллами), в типичной
животнойклетке. Органеллы:
(1) Ядрышко
(2) Ядро
(3) рибосома (маленькиеточки)
(4) Везикула
(5)шероховатый эндоплазматическийретикулум(ER)
(6) АппаратГольджи
(7) Цитоскелет
(8)Гладкий эндоплазматический
ретикулум
(9) Митохондрия
(10) Вакуоль
(11) Цитоплазма
(12) Лизосома
(13) Центриоль и Центросома
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно, его называют конденсированным или гетерохроматином, он хорошо виден под микроскопом. ДНК, находящаяся в гетерохроматине, не транскрибируется, обычно это состояние характерно для незначимых или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки. Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием.
Считается, что в ядре существуют так называемые функциональные домены хроматина(ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». К сожалению, вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №2
Тема урока: Ядерная оболочка, ядерная ламина и ядерные поры (кариолемма)
Цель: развивать и углублять знания по темеядерная оболочка, ядерная ламина и ядерные поры
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема: От цитоплазмы ядро отделено ядерной оболочкой, образованной за счёт расширения и слияния друг с другом цистерн эндоплазматической сети таким образом, что у ядра образовались двойные стенки за счёт окружающих его узких компартментов. Полость ядерной оболочки называется люменом или перинуклеарным пространством. Внутренняя поверхность ядерной оболочки подстилается ядерной ламиной, жёсткой белковой структурой, образованной белками-ламинами, к которой прикреплены нити хромосомной ДНК. Ламины прикрепляются к внутренней мембране ядерной оболочки при помощи заякоренных в ней трансмембранных белков — рецепторов ламинов. В некоторых местах внутренняя и внешняя мембраны ядерной оболочки сливаются и образуют так называемые ядерные поры, через которые происходит материальный обмен между ядром и цитоплазмой. Пора не является дыркой в ядре, а имеет сложную структуру, организованную несколькими десятками специализированных белков — нуклеопоринов. Под электронным микроскопом она видна как восемь связанных между собой белковых гранул с внешней и столько же с внутренней стороны ядерной оболочки.
Различные структуры клеточного ядра видны из-за накопления в них зелёного флуоресцентного белка
Ядрышко находится внутри ядра, и не имеет собственной мембранной оболочки, однако хорошо различимо под световым и электронным микроскопом. Основной функцией ядрышка является синтезрибосом. В геноме клетки имеются специальные участки, так называемые ядрышковые организаторы, содержащие гены рибосомной РНК (рРНК), вокруг которых и формируются ядрышки. В ядрышке происходит синтез рРНК РНК полимеразой I, её созревание, сборка рибосомных субчастиц. В ядрышке локализуются белки, принимающие участие в этих процессах. Некоторые из этих белков имеют специальную последовательность — сигнал ядрышковой локализации (NoLS, от англ. NucleolusLocalization Signal). Следует отметить, самая высокая концентрация белка в клетке наблюдается именно в ядрышке. В этих структурах было локализовано около 600 видов различных белков, причем считается, что лишь небольшая их часть действительно необходима для осуществления ядрышковых функций, а остальные попадают туда неспецифически.
Под электронным микроскопом в ядрышке выделяют несколько субкомпартментов. Так называемые Фибриллярные центры окружены участками плотного фибриллярного компонента, где и происходит синтез рРНК. Снаружи от плотного фибриллярного компонента расположен гранулярный компонент, представляющий собой скопление созревающих рибосомных субчастиц.
Ядерный матрикс
Ядерным матриксом некоторые исследователи называют нерастворимый внутриядерный каркас. Считается, что матрикс построен преимущественно из негистоновыхбелков, формирующих сложную разветвленную сеть, сообщающуюся с ядерной ламиной. Возможно, ядерный матрикс принимает участие в формировании функциональных доменов хроматина. В геноме клетки имеются специальные незначащие А-Т-богатые участки прикрепления к ядерному матриксу (англ. S/MAR —Matrix/Scaffold Attachment Regions), служащие, как предполагается, для заякоривания петель хроматина на белках ядерного матрикса. Впрочем, не все исследователи признают существование ядерного матрикса.
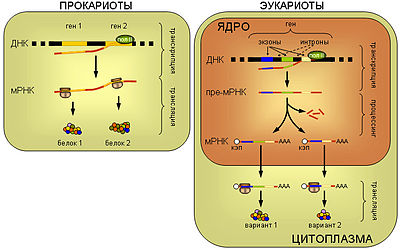
Принципиальная схема реализации
генетической информации у про- и эукариот.
ПРОКАРИОТЫ. У прокариот синтез белка рибосомой (трансляция)
пространственно не отделен от транскрипции и может происходить ещё до завершения
синтеза мРНК РНК-полимеразой.
Прокариотические мРНК часто полицистронные, то
есть содержат несколько независимых генов.
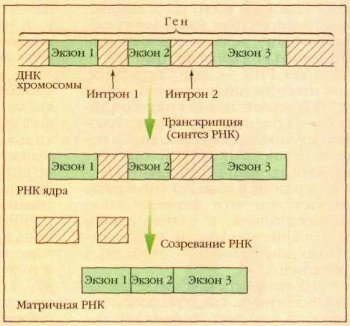
ЭУКАРИОТЫ. мРНК эукариот синтезируется в виде предшественника, пре-мРНК,
претерпевающего затем сложное стадийное
созревание — процессинг,
включающий присоединениекэп-структуры
к 5'-концу
молекулы, присоединение нескольких десятков
остатков аденина к
её 3'-концу
(полиаденилирование), выщепление незначащих
участков — интронов и
соединение друг с другом значащих
участков — экзонов (сплайсинг). При
этом соединение экзонов одной и той же пре-мРНК может проходить
разными способами, приводя к образованию разных зрелых мРНК, и в
конечном итоге разных вариантов белка (альтернативный сплайсинг).
Только мРНК, успешно прошедшая процессинг, экспортируется из ядра в
цитоплазму и вовлекается в трансляцию.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №3
Тема урока: Эволюционное значение ядра
Цель: развивать и углублять знания по темеэволюционное значение ядра
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема:
Основное функциональное отличие клеток эукариот от клеток прокариот заключается в пространственном разграничении процессов транскрипции (синтеза матричной РНК) и трансляции(синтеза белка рибосомой), что дает в распоряжение эукариотической клетки новые инструменты регуляции биосинтеза и контроля качества мРНК.
В то время, как у прокариот мРНК начинает транслироваться ещё до завершения её синтеза РНК-полимеразой, мРНК эукариот претерпевает значительные модификации (так называемый процессинг), после чего экспортируется через ядерные поры в цитоплазму, и только после этого может вступить в трансляцию. Процессинг мРНК включает несколько элементов.
Из предшественника мРНК (пре-мРНК) в ходе процесса, называемого сплайсингом вырезаютсяинтроны — незначащие участки, а значащие участки — экзоны соединяются друг с другом. Причем экзоны одной и той же пре-мРНК могут быть соединены несколькими разными способами (альтернативный сплайсинг), так что один предшественник может превращаться в зрелые мРНК нескольких разных видов. Таким образом, один ген может кодировать сразу несколько белков.
Кроме того, интрон-экзонная структура генома, практически невозможная у прокариот (так как рибосомы смогут транслировать незрелые мРНК), дает эукариотам определенную эволюционнуюмобильность. Учитывая протяженность интронных участков, рекомбинация между двумя генами зачастую сводится к обмену экзонами. Благодаря тому, что экзоны часто соответствуют функциональным доменам белка, участки получившегося в результате рекомбинации «гибрида», зачастую сохраняют свои функции. В то же время у прокариот рекомбинация между генами невозможна без разрыва в значащей части, что безусловно уменьшает шансы на то, что получившийся белок будет функционален.
Модификациям подвергаются концы молекулы мРНК. К 5' -концу молекулы прикрепляется 7-метилгуанин (так называемый кэп). К 3'-концу нематрично присоединяются несколько десятков остатковаденина (полиаденирование).
Процессинг мРНК тесно сопряжен с синтезом этих молекул и необходим для контроля качества. Непроцессированная или не полностью процессированная мРНК не сможет выйти из ядра в цитоплазму или будет нестабильна и быстро деградирует. У прокариот нет таких механизмов контроля качества, и из-за этого прокариотические мРНК имеют меньший срок жизни — нельзя допустить, чтобы неправильно синтезированная молекула мРНК, если такая появится, транслировалась в течение долгого времени.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №4
Тема урока: Происхождение ядра
Цель: развивать и углублять знания по темепроисхождение ядра
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учеников к уроку
Новая тема: Клеточное ядро является важнейшей чертой эукариотических организмов, отличающей их от прокариот и архей. Несмотря на значительный прогресс в цитологии и молекулярной биологии, происхождение ядра не выяснено и является предметом научных споров. Выдвинуто 4 основных гипотезы происхождения клеточного ядра, но ни одна из них не получила широкой поддержки
Гипотеза, известная как «синтропная модель», предполагает что ядро возникло в результате симбиотических взаимоотношений между археей и бактерией (ни археи, ни бактерии не имеют оформленных клеточных ядер). По этой гипотезе, симбиоз возник, когда древняя архея (сходная с современными метаногенными археями), проникла в бактерию (сходную с современными Миксобактериями). Впоследствии архея редуцировалась до клеточного ядра современных эукариот. Эта гипотеза аналогична практически доказанным теориям происхождения митохондрий и хлоропластов, которые возникли в результате эндосимбиоза прото-эукариот и аэробных бактерий Доказательством гипотезы является наличие одинаковых генов у эукариот и архей, в частности генов гистонов. Также миксобактерии быстро передвигаются, могут образовывать многоклеточные структуры и имеют киназы и G-белки, близкие к эукариотическим.
Согласно второй гипотезе, прото-эукариотическая клетка эволюционировала из бактерии без стадии эндосимбиоза. Доказательством модели является существование современных бактерий из отряда Planctomycetes, которые имеют ядерные структуры с примитивными порами и другие клеточные компартменты, ограниченные мембранами (ничего похожего у других прокариот не обнаружено).Согласно гипотезе вирусного эукариогенеза, окруженное мембраной ядро, как и другие эукариотические элементы, произошли вследствие инфекции прокариотической клетки вирусом. Это предположение основывается на наличии общих черт у эукариот и некоторых вирусов, а именно геноме из линейных цепей ДНК, кэпировании мРНК и тесном связывании генома с белками (гистоны эукариот принимаются аналогами вирусных ДНК-связывающих белков). По одной версии, ядро возникло прифагоцитировании (поглощении) клеткой большого ДНК-содержащего вируса. По другой версии, эукариоты произошли от древних архей, инфицированныхпоксвирусами. Эта гипотеза основана на сходстве ДНК-полимеразы современных поксвирусов и эукариот Также предполагается, что нерешенный вопрос о происхождении пола и полового размножения может быть связан с вирусным эукариогенезом.
Наиболее новая гипотеза, названная экзомембранной гипотезой, утверждает, что ядро произошло от одиночной клетки, которая в процессе эволюции выработала вторую внешнюю клеточную мембрану; первичная клеточная мембрана после этого превратилась в ядерную мембрану, и в ней образовалась сложная система поровых структур (ядерных пор) для транспорта клеточных компонентов, синтезированных внутри ядра.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №5
Тема урока: Молекулярный механизм репликации
Цель урока: развивать и углублять знания по темемолекулярный механизм репликации
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема: Ферменты (хеликаза, топоизомераза) и ДНК-связывающие белки расплетают ДНК, удерживают матрицу в разведённом состоянии и вращают молекулу ДНК. Правильность репликации обеспечивается точным соответствием комплементарных пар оснований и активностью ДНК-полимеразы, способной распознать и исправить ошибку. Репликация у эукариот осуществляется несколькими разными ДНК-полимеразами. ДНК-полимераза I действует на запаздывающей цепи для удаления РНК-праймеров и дорепликации очищенных мест ДНК. ДНК полимераза III — основной фермент репликации ДНК, осуществляющий синтез ведущей цепи ДНК и фрагментов Оказаки при синтезе запаздывающей цепи. Далее происходит закручивание синтезированных молекул по принципу суперспирализации и дальнейшей компактизации ДНК. Синтез энергозатратный.
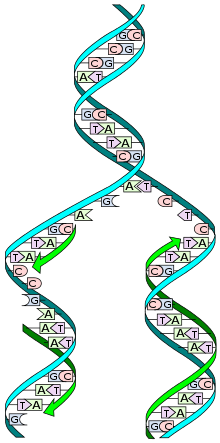
Цепи молекулы ДНК расходятся, образуют репликационную вилку, и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две новые двуспиральные молекулы ДНК, идентичные родительской молекуле.
Характеристики процесса репликации
-
матричный — последовательность синтезируемой цепи ДНК однозначно определяется последовательностью материнской цепи в соответствии с принципом комплементарности;
-
полуконсервативный — одна цепь молекулы ДНК, образовавшейся в результате репликации, является вновь синтезированной, а вторая — материнской;
-
идёт в направлении от 5’-конца новой молекулы к 3’-концу;
-
полунепрерывный — одна из цепей ДНК синтезируется непрерывно, а вторая — в виде набора отдельных коротких фрагментов (фрагментов Оказаки);
-
начинается с определённых участков ДНК, которые называются сайтами инициации репликации (англ. origin)
Особенности репликации
1. Для эукариотических клеток характерно наличие множества точек начала репликации. Одновременное удвоение ДНК во многих участках значительно сокращает продолжительность всего процесса.
Точка начала репликации имеет специфическую последовательность оснований, богатую парами А – Т, что, вероятно, облегчает разделение цепей. Отрезок ДНК, репликация которого протекает под контролем одной точки начала репликации, образует репликон. В каждом репликоне присутствуют точка инициации (область начала репликации, от англ. replication origin – ori) и точка окончания (terminalis).
2. Репликация распространяется в обе стороны от каждой точки начала репликации. При этом образуются две репликативные вилки, движущиеся в противоположных направлениях (ранняя стадия репликации,
рис. 1). Между репликативными вилками появляется постепенно расширяющийся «глазок»: это уж реплицированные отделы ДНК. В итоге соседние зоны репликации («глазки») сливаются, и вся молекула ДНК оказывается удвоенной (поздняя стадия репликации, рис. 1).
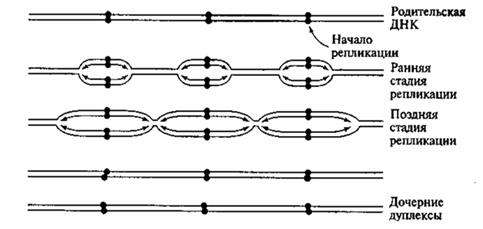
Рис. 1. Множественная двунаправленная репликация эукариотической ДНК
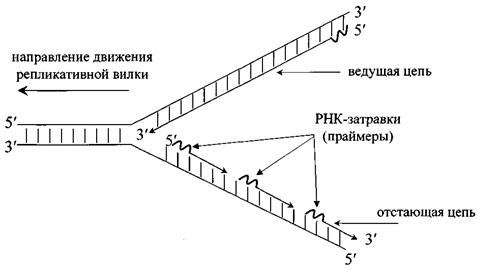
Рис. 2. Репликативная вилка
3. Движение репликативной вилки сопровождается одновременным считыванием двух матричных цепей. Поскольку синтез дочерних цепей ДНК осуществляется антипараллельно матричным и всегда в направлении 5′®3′, то лишь одна дочерняя цепь ДНК будет синтезироваться непрерывно. Эта цепь называется ведущей или лидирующей. Направление ее синтеза совпадает с направлением расплетания двойной спирали (рис. 2). На второй матричной цепи ДНК синтезируется сравнительно короткими фрагментами, названными фрагментами Оказаки (1000-2000 нуклеотидов у прокариот и 100-200 нуклеотидов в реплицирующейся ДНК эукариот). Синтез каждого фрагмента Оказаки также идет в направлении 5′®3′. В виде фрагментов Оказаки синтезируется та цепь, направление образования которой противоположно движению соответствующей репликативной вилки. Эта цепь называется отстающей или запаздывающей.
Рис. 2. Репликативная вилка
4. Образованию каждого нового фрагмента ДНК (как длинного фрагмента ведущей цепи, так и любого из фрагментов Оказаки отстающей цепи) предшествует синтез короткой последовательности РНК-затравки (праймера) из 10-15 нуклеотидов. Основной фермент, синтезирующий ДНК (ДНК-полимераза), не может начинать процесс «с нуля», а лишь достраивает 3′-конец уже имеющейся нуклеотидной последовательности. В противоположность этому, фермент ДНК-праймаза такой способностью обладает. Через некоторое время РНК-затравки удаляются и образовавшиеся бреши застраиваются ДНК-полимеразой. В дальнейшем все многочисленные фрагменты ДНК, образованные на одной родительской цепи, сшиваются специальным ферментом ДНК-лигазой в одну непрерывную цепь.
Процесс репликации осуществляется сложным ферментным комплексом, включающим 15-20 белков, которые условно разделяют на три группы.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №6
Тема урока:Репликация основной части ДНК
Цель урока: развивать и углублять знания по темерепликация основной части ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема: Реплика́ция (от лат. replicatio — возобновление) — процесс синтеза дочерней молекулыдезоксирибонуклеиновой кислоты на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15—20 различных белков, называемый реплисомой
Схематическое изображение процесса репликации, цифрами отмечены: (1) запаздывающая нить, (2) лидирующая нить, (3) ДНК-полимераза (Polα), (4) ДНК-лигаза, (5) РНК-праймер, (6) праймаза, (7) фрагмент Оказаки, (8) ДНК-полимераза (Polδ), (9) хеликаза, (10) одиночная нить со связанными белками, (11)топоизомераза
Процесс репликации: раскручивание двойной спирали ДНК — синтез комплементарных цепей ДНК-полимеразой — образование двух молекул ДНК из одной.
Каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Такой механизм репликации называется полуконсервативным. В настоящее время этот механизм считается доказанным благодаряопытам Мэтью Мезельсона и Франклина Сталя (1958 г.). Ранее существовали и две другие модели: «консервативная» — в результате репликации образуется одна молекула ДНК, состоящая только из родительских цепей, и одна, состоящая только из дочерних цепей; «дисперсионная» — все получившиеся в результате репликации молекулы ДНК состоят из цепей, одни участки которых вновь синтезированы, а другие взяты из родительской молекулы ДНК.
Репликация ДНК — ключевое событие в ходе деления клетки. Принципиально, чтобы к моменту деления ДНК была реплицирована полностью и при этом только один раз. Это обеспечивается определёнными механизмами регуляции репликации ДНК. Репликация проходит в три этапа:
-
инициация репликации
-
элонгация
-
терминация репликации.
Регуляция репликации осуществляется в основном на этапе инициации. Это достаточно легко осуществимо, потому что репликация может начинаться не с любого участка ДНК, а со строго определённого, называемого сайтом инициации репликации. Вгеноме таких сайтов может быть как всего один, так и много. С понятием сайта инициации репликации тесно связано понятиерепликон. Репликон — это участок ДНК, который содержит сайт инициации репликации и реплицируется после начала синтеза ДНК с этого сайта. Геномы бактерий, как правило, представляют собой один репликон, это значит, что репликация всего генома является следствием всего одного акта инициации репликации. Геномы эукариот (а также их отдельные хромосомы) состоят из большого числа самостоятельных репликонов, это значительно сокращает суммарное время репликации отдельной хромосомы. Молекулярные механизмы, которые контролируют количество актов инициации репликации в каждом сайте за один цикл деления клетки, называются контролем копийности. В бактериальных клетках помимо хромосомной ДНК часто содержатся плазмиды, которые представляют собой отдельные репликоны. У плазмид существуют свои механизмы контроля копийности: они могут обеспечивать синтез как всего одной копии плазмиды за клеточный цикл, так и тысяч копий.
Репликация начинается в сайте инициации репликации с расплетания двойной спирали ДНК, при этом формируется репликационная вилка — место непосредственной репликации ДНК. В каждом сайте может формироваться одна или две репликационные вилки в зависимости от того, является ли репликация одно- или двунаправленной. Более распространена двунаправленная репликация. Через некоторое время после начала репликации в электронный микроскоп можно наблюдать репликационный глазок — участок хромосомы, где ДНК уже реплицирована, окружённый более протяжёнными участками нереплицированной ДНК
В репликационной вилке ДНК копирует крупный белковый комплекс (реплисома), ключевым ферментом которого является ДНК-полимераза. Репликационная вилка движется со скоростью порядка 100 000 пар нуклеотидов в минуту у прокариот и 500—5000 — у эукариот
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Дата: 13.10.16
Урок №7
Тема урока: Репликация теломерных отделов
Цель: развивать и углублять знания по темерепликация теломерных отделов ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая
тема: Теломераза – это
фермент‚ синтезирующий тандемно повторяющиеся сегменты ДНК, из
которых состоит G-цепь теломерной ДНК.
она относится к классу ДНК-полимераз
- теломераза - это РНК-зависимая ДНК-полимераза или обратная
транскриптаза.
- Ферменты этого класса, синтезирующие ДНК на РНК-матрицах, очень
хорошо известны молекулярным биологам. Они закодированы и
содержатся в ретровирусах (например, в вирусе иммунодефицита
человека, вызывающем заболевание СПИДом) и служат для синтеза
ДНК-копий их геномов, который в ретровирусе представлен
РНК.
- В клеточном геноме обратные транскриптазы закодированы в
ретротранспозонах.
- РНК, используемая теломеразой для синтеза теломерной ДНК в
качестве матрицы, входит в состав этого фермента. В этом
уникальность теломеразы: на сегодня это единствення известная
РНК-содержащая обратная транскриптаза.
- Теломеразные РНК у разных организмов сильно различаются по длине
и структуре.
- Теломеразы простейших содержат РНК длиной в 150-200 нуклеотидных
остатков (н.о.),
- длина теломеразной РНК человека - 450 н.о.,
- теломераза дрожжей содержит аномально длинную РНК (около 1300
н.о.).
- Как и любая другая РНК клетки, теломеразная РНК обладает
специфической вторичной и третичной структурой. Вторичная структура
изолированной теломеразной РНК достоверно установлена только для
теломераз простейших. Пространственная структура теломеразной РНК в
составе ферментативного комплекса пока еще неизвестна.
- Матричный участок представлен в теломеразной РНК только один раз.
Его длина не превышает длину двух повторов в теломерной ДНК,
которые он кодирует и которым он, разумеется,
комплементарен.
- Так как теломераза синтезирует сегменты ДНК, повторяющиеся много
раз, используя только один сегмент своей РНК, она должна обладать
способностью периодически (после завершения синтеза каждого
повтора) перемещать (транслоцировать) матричный участок в район
3'-конца синтезируемой теломерной ДНК. Источником энергии для
такого перемещения, по-видимому, служит сама реакция синтеза цепи
теломерной ДНК, поскольку дезоксинуклеозидтрифосфаты - субстраты
этой реакции - высокоэнергетические вещества.
Такое удлинение возможно, потому что концы хромосом содержат
повторы из нескольких нуклеотидов (например, у человека ТТАGGG),
которым комплементарен участок РНК - компонента теломеразы. Таким
образом, теломераза узнает выступающий 3'-конец и удлиняет его. В
таком случае удается, снова с использованием ДНК-затравки и
РНК-матрицы, достроить конец ДНК Теломеразная машина устроена таким
образом, что конец хромосомы может не только сохраняться, но и
удлиняться в ряду поколений. Действительно, последнее нетрудно себе
представить, если достраиваемый 3'-конец будет достаточно длинным.
Одна из причин старения видится в том, что при отсутствии
теломеразы в некоторых тканях происходит укорачивание хромосомы с
потерей важных генов. Наоборот, бессмертие ряда клеток в культуре
вне организма, свойственное, как правило, клеткам из опухолей,
объясняется реактивацией теломеразы. Мы кратко рассмотрели эту
интересную проблему, связанную с активностью теломеразы и вечными
проблемами биологического старения и опухолевого роста, поскольку
оказалось, что иногда в борьбу с укорочением концов хромосом
вступают мобильные элементы. У плодовой мушки дрозофилы отсутствует
теломеразная машина, но концы ДНК удлиняются за счет перемещений
ретротранспозонов. На этом примере впервые показана важная
структурная и функциональная роль ретротранспозонов. Они выступают
как компоненты генома, спасающие хромосому от укорачивания. В
качестве спасателей выступают ретротранспозоны, относящиеся к
семействам, без длинных концевых повторов. Ретротранспозоны
перемещаются, образуя повторяющуюся структуру, в которой элементы
соединены друг с другом по типу "голова к хвосту" Сначала на
РНК-транскрипте как на матрице с помощью ревертазы строится
комплементарная нить ДНК, а затем после удаления РНК-матрицы
достраивается другая. Таким образом, если эти ретротранспозоны и
существовали когда-то как элементы-паразиты, то впоследствии геном
хозяина приспособил их для выполнения столь важной функции, как
сохранение концевых участков хромосом. Эти ретротранспозоны стали
уже не эгоистами, а бесценными помощниками, спасающими хромосому от
потери генов.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №8
Тема урока: Механизм действия теломеразы
Цель урока: развивать и углублять знания о механизме действия теломеразы
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема:
1.
На первой стадии теломераза находит 3'-конец теломерной ДНК, с
которым часть матричного участка теломеразной РНК образует
комплементарный комплекс. При этом теломераза используети 3'-конец хромосомной ДНК в качестве
праймера.
2. Далее наступает очередь РНК-зависимой
ДНК-полимеразной активности теломеразы. Она обеспечивается
специальной субъединицей теломеразы, которая по устройству своего
каталитического центра во многом сходна с обратными транскриптазами
ретровирусов и ретротранспозонов.
3. Когда синтез ДНК-повтора заканчивается,
происходит транслокация, то есть перемещение матрицы и белковых
субъединиц фермента на заново синтезированный конец теломерной ДНК,
и весь цикл повторяется вновь.
Знакомство даже с весьма схематичным описанием механизма
теломеразной реакции приводит к заключению, что двумя компонентами
- обратной транскриптазой и теломеразной РНК - для ее осуществления
обойтись нельзя.
Нет сомнений в том, что в его составе должны быть субъединица,
отвечающая за поиск и связывание 3'-конца хромосомы (и выполняющая
таким образом своеобразную якорную функцию); субъединица,
ответственная за транслокацию; субъединицы, связывающие продукт
реакции (однотяжевую ДНК). В составе теломеразы обычно
обнаруживается и белковая субъединица с нуклеазной активностью,
которая, по-видимому, отщепляет от 3'-конца теломерной ДНК один за
другим несколько нуклеотидов до тех пор, пока на этом конце не
окажется последовательность, комплементарная нужному участку
матричного сегмента теломеразной РНК. Эти субъединицы теломеразы,
выполняющие разнообразные функции в ходе синтеза G-цепи теломерной
ДНК, изображены на рис. 4, на котором приведена гипотетическая
структура теломеразы дрожжей. Нужно еще раз подчеркнуть, что полный
белковый состав фермента не известен до сих пор ни в одном случае.
Широкое распространение теломераз среди эукариот говорит о том, что
механизм синтеза теломерной ДНК, который мы наблюдаем у современных
организмов, возник очень давно. Более того,
эволюционно-генетический сравнительный анализ нуклеотидных
последовательностей генов каталитических субъединиц теломераз и
других обратных транскриптаз показывает, что этот механизм мог
существовать еще до появления первых эукариотических
клеток.
С-цепь теломерной ДНК синтезируется с помощью обычной
ДНК-полимеразы Поэтому 3'-концевой участок G-цепи, на котором,
по-видимому, первоначально была РНК-затравка, в конечном итоге
остается в однотяжевом состоянии (то есть в принципе он готов к
тому, чтобы теломераза нарастила на нем новый повтор).
Активность теломеразы у высших эукариот обнаружена лишь в трех
типах клеток:
- генеративных,
- раковых
- линиях иммортализованных клеточных культур.
половых и стволовых клетках. В остальных типах клеток синтез этого
фермента прекращается еще в эмбриональный период развития
В организме при дифференцировке клеток теломераза репрессируется.
Экспрессию теломеразы считают фактором иммортализации клеток.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №9
Тема: Механизм действия теломеразы в соматических клетках
Цель: развивать и углублять знания по темемеханизм действия теломеразы в соматических клетках
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая
тема: В соматических
клетках, культивируемых in vitro, теломераза не работает и теломеры
постепенно укорачиваются. Длина теломер достоверно коррелирует с
пролиферативным потенциалом (например, в фибробластах человека).
Укорочение теломер может играть роль митотических часов,
отсчитывающих число делений клетки. По достижении критической длины
теломерной ДНК запускаются процессы остановки клеточного цикла.
Блок клеточных делений наступает еще до того, как теломера исчезла
вовсе. Существует некоторая минимальная длина теломеры, когда
деление еще разрешено. Иными словами, прекращение деления наступает
до того, как начал разрушаться смысловой текст генома. Таким
способом эукариоты страхуют себя от появления монстров вследствие
недорепликации ДНК.
Опубликованная в 1998 году в журнале "Science" статья американских
исследователей благодаря средствам массовой информации привлекла
внимание не только ученых (а в первую очередь не ученых) в связи с
проблемами старения и "клеточного бессмертия". В этой прекрасной
работе коллектива, возглавляемого Джерри Шеем, удалось на 40%
увеличить число делений нормальных соматических клеток человека в
культуре. С помощью генно-инженерных методов в клетки был введен
ген каталитической белковой субъединицы теломеразы и прилегающий к
нему участок ДНК, регулирующий его работу. При активной работе гена
увеличивался как размер теломерной ДНК, так и продолжительность
жизни клеточных культур. Сверх обычных 50 делений клетки прошли
дополнительно 20 делений.
Укорочение теломер можно рассматривать как молекулярный индикатор
количества делений, но не старения клетки. Так, на культуре
нормальных фибробластов человека, взятых от доноров в возрасте от 0
до 93 лет, выявили корреляцию между начальной длиной теломер и
пролиферативной способностью клетки во всем диапазоне возрастов. А
размер теломерной ДНК сперматозоидов не уменьшался в соответствии с
возрастом мужчины, что говорит об экспрессии теломеразы в линии
половых клеток. Прекращение работы теломеразы, отмечаемое в
подавляющем большинстве дифференцированных соматических клеток
животных, является свидетельством их зрелости, а стало быть, и
неизбежно следующих затем процессов увядания и гибели.
Старение особи - это нормальная биологическая функция,
способствующая прогрессивной эволюции вида, размножающегося половым
путем. Давление естественного отбора ослабевает после достижения
животным репродуктивного успеха, поскольку существование особи
после этого имеет меньшее значение для вида. Смерть от старости
удаляет из популяции выполнивших свою роль предков и дает простор
потомкам - носителям новых полезных признаков. Как любая важная
биологическая функция, старение обусловлено параллельным действием
нескольких молекулярных механизмов. Выключение теломеразы - лишь
один из них.
Не стоит рассматривать гены, кодирующие белковые субъединицы
теломеразы и входящую в ее состав РНК, как "гены бессмертия".
Поддержание длины теломерной ДНК на определенном уровне зависит не
только от взаимодействия с ней теломеразы и теломерсвязывающих
белков, но и некоторых, пока неизвестных факторов, регулирующих
образование самих компонентов теломеробразующего
комплекса.
Вряд ли бессмертие, достигнутое раковыми клетками, размножающимися
в культуре десятилетиями без укорочения теломер, - это то, к чему
нужно стремиться. Лекарства от смерти нет. Но тот факт, что
введение в такие клетки препаратов, связывающих РНК-компонент
теломеразы, приводит к укорочению теломер с последующей гибелью
клеток, вселяет надежду на появление новых средств борьбы с
раком.
Понимание механизма работы теломеразы, а главное, регуляции
экспрессии ее в клетке приблизит нас к пониманию процессов и
злокачественной трансформации и старения.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №10
тема урока: Теломераза, рак и старение.
Цель: развивать и углублять знания по теметеломераза, рак и старение.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая
тема:
Вопрос о том, в какой мере теломерный механизм участвует в старении
многоклеточных организмов. Вполне возможно, что они изобрели совсем
иные программы старческого феноптоза. Однако несомненно, что у
людей - рекордсменов по долгожительству уменьшение длины теломер
уже приближается к той роковой черте, за которой наступает запрет
на размножение клеток. Так, по данным группы К. Сасаджимы из
Японии, теломеры в клетках печени стариков старше 80 лет
оказываются почти вдвое короче, чем у детей до 8 лет. По-видимому,
продлить жизнь тем, кому за 100, можно лишь при условии, что
удастся нарастить их теломеры, включив на какое-то время теломеразу
в печени и других тканях, где этот фермент выключился еще во время
эмбрионального развития.
Высокая теломеразная активность наблюдается в половых клетках
человека в течение всей его жизни. Соответственно их теломеры
состоят из наибольшего числа ДНК-повторов и содержат все
необходимые белки для нормальной пролиферации клеток. Аналогичная
ситуация наблюдается и для стволовых клеток. Напомним, что
стволовые клетки делятся неограниченно долго. Однако у стволовой
клетки всегда есть возможность дать две дочерние клетки, одна из
которых останется стволовой ("бессмертной"), а другая вступит в
процесс дифференцировки. Благодаря этому стволовые клетки служат
постоянным источником разнообразных клеток организма. Например,
стволовые клетки костного мозга дают начало гемопоэзу - процессу
образования клеток крови, а из базальных клеток эпидермиса
происходят разнообразные клетки кожного покрова. Как только потомки
половых или стволовых клеток начинают дифференцироваться,
активность теломеразы падает и их теломеры начинают укорачиваться.
В клетках, дифференцировка которых завершена, активность теломеразы
падает до нуля, и, как мы уже отмечали, с каждым клеточным делением
они с неизбежностью приближаются к состоянию сенесенса (перестают
делиться). Вслед за этим наступает кризис, и большинство клеток
погибают Эта картина характерна для подавляющего большинства
известных культур клеток эукариот. Однако и здесь есть редкие, но
важные исключения: теломеразная активность обнаруживается в таких
"смертных" клетках, как макрофаги и лейкоциты.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Тема урока: Метилирование ДНК
Цель урока:развивать и углублять знания по темеметилирование ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема:
Метилирование ДНК — это модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома
Метилирование ДНК заключается в присоединении метильной группы к цитозину в составе CpG-динуклеотида в позиции С5 цитозинового кольца. Метилированный цитозин может затем окисляться особыми ферментами, что в конечном итоге приводит к его деметилированию обратно в цитозин[4].
Метилирование ДНК считается, в основном, присущим эукариотам. У человека метилировано около 1 % геномной ДНК. В соматических клетках взрослого организма метилирование ДНК обычно происходит в CpG-динуклеотидах; метилирование ДНК вне CpG-динуклеотидов встречается в эмбриональных стволовых клетках.
Более того, метилирование ДНК вне CpG-динуклеотидов является отличительной чертой эпигенома плюрипотентных стволовых клеток, а снижение не-CG метилирования связано с нарушением способности к дифференцировке в энтодермальные линии клеток[7]
У растений метилирование цитозина происходит как симметрично по обеим цепям (на CpG или CpNpG), так и асимметрично лишь на одной из двух цепей (на CpNpNp, где N обозначает любой нуклеотид).
Отрезок молекулы ДНК, в центре которого находятся два симметрично (по обеим цепям) расположенных метилцитозина в составе CpG-динуклеотидов.
ДНК у млекопитающихОколо 60—70 % всех CpG-динуклеотидов у млекопитающих метилированы. Неметилированные CpG-динуклеотиды сгруппированы в т. н. «CpG-островки», которые присутствуют в 5' регуляторных областях многих генов. Различные заболевания, например, рак, сопровождаются начальным аномальным гипометилированием ДНК и последующим гиперметилированием CpG-островков в промоторных областях генов, что приводит к устойчивой репрессии транскрипции. Репрессия транскрипции в этом случае опосредована белками, которые способны связываться с метилированными CpG-динуклеотидами. Эти белки, называемые метилцитозин-связывающими белками, привлекают деацетилазу гистонов (HDAC) и другие факторы, участвующие в ремоделировании хроматина. Сформировавшийся комплекс может модифицировать гистоны, формируя конденсированную транскрипционно неактивную структуру гетерохроматина. Влияние метилирования ДНК на структуру хроматина имеет большое значение для развития и функционирования живого организма. В частности, отсутствие метилцитозин-связывающего белка 2 (MeCP2) вследствие, например, мутации в соответствующем гене, приводит к развитию синдрома Ретта у человека; инактивация метилцитозин-связывающего доменного белка 2 (Methyl-CpG binding domain protein 2 — MBD2), который участвует в репрессии транскрипции гиперметилированных генов, отмечена при онкологических заболеваниях.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №12
Тема урока: Метилирование ДНК у человека
Цель урока: развивать и углублять знания по теме метилирование ДНК у человека
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: У человека за процесс метилирования ДНК отвечают три фермента, называемые ДНК-метилтрансферазами 1, 3a и 3b (DNMT1, DNMT3a, DNMT3b), соответственно. Предполагается, что DNMT3a и DNMT3b — это de novo метилтрансферазы, которые осуществляют формирование паттерна метилирования ДНК на ранних стадиях развития, а также его изменения в процессе дифференцировки клеток. Существует гипотеза о том, что метилирование ДНК de novo вызывается, в частности,интерферирующими РНК при помощи РНК-зависимого метилирования ДНК — процесса, возникшего в ходе эволюции с целью репрессии мобильных элементов генома. DNMT1 является ДНК-метилтрансферазой, которая поддерживает метилированное состояние ДНК, присоединяя метильные группы к одной из цепей ДНК в точках, где другая, комплементарная ей цепь, метилирована. Предполагается, что роль ингибиторов ДНК метилазы DNMT1 регулирующих метилирование ДНК выполняют не-полиаденилированные длинные некодирующие РНК (lncRNA) Белок DNMT3L гомологичен другим DNMT-белкам, но не имеет каталитической активности. Вместо этого, DNMT3L поддерживает de novo метилтрансферазы, способствуя связыванию этих ферментов с ДНК и стимулируя их активность.
Важными этапами в развитии злокачественных новообразований является предварительное гипометилирование ДНКи последующая инактивация генов-супрессоров опухолевого роста[11]. В случае, когда инактивация была обусловлена метилированием промоторной области гена, проводились эксперименты по возобновлению экспрессии путём ингибирования DNMT. 5-aza-2'-дезоксицитидин (децитабин) является нуклеозидным аналогом, ингибирующим DNMT метилтрансферазы. Механизм действия препарата основан на ковалентном связывании фермента в комплексе с ДНК, что делает невозможным выполнение ферментом своей функции и приводит к деградации метилтрансферазы. Однако для того, чтобы децитабин был активен, он должен встроиться в геном клетки, но это, в свою очередь, может вызвать мутации в дочерних клетках, если клетка не погибает и продолжает деление. К тому же, децитабин токсичен для костного мозга, что сужает область его терапевтического применения. Эти ограничения привели к интенсивному поиску методов терапевтического воздействия, основанных на использовании «антисмысловых» РНК, которые противодействуют DNMT посредством деградации её мРНК и, следовательно, блокируют трансляцию. Возможность осуществить избирательно деметилирование гена и таким образом изменить его экспрессию дает открытие, так называемой, экстракодирующей РНК (extracoding RNA), которая способна связываться с DNMT1, блокируя его способность осуществлять метилирование конкретного гена. Тем не менее, по-прежнему остаётся открытым вопрос о том, является ли ингибирование функции DNMT1 достаточным условием для увеличения экспрессии генов-супрессоров, негативная регуляция транскрипции которых осуществляется метилированием ДНК.
Анализ персональных транскриптомов и метилломов человека показал, что корреляция между метилированием и экспрессией генов наблюдается только у менее 20% генов
Янг с соавт. разработали эффективный метод избирательного целевого деметилирования конкретных CpG в клетках человека с использованием объединенного путем молекулярной инженерии избирательно связывающего ДНК домена TALE (transcription activator-like effector) и каталитического домена TET1 гидроксилазы катализирующего превращение 5-метилцитозина в 5-гидроксиметилцитозин. Используя эту объединенную молекулу TALE-TET1, они показали, что деметилирование определенных CpG промотора может привести к существенному увеличению экспрессии соответствующих генов человека.
Разработана среда, которая вызывает гипометилирование ДНК в клетках in vitro. Эта среда, называемая 2i, содержит два низкомолекулярных ингибитора, один из которых ингибирует сигнальный путь ERK1 / 2, а другой Gsk3β. Она широко используется для перепрограммирования и поддержания плюрипотентного состояния клеток.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №13
Тема урока: Роль метилирования в онкогенезе
Цель урока: развивать и углублять знания по теме метилирования в онкогенезе
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Эпигенетический возраст, как выяснилось, влияет на вероятность заболеть раком. Был разработан алгоритм для вычисления эпигенетического возраста по данным метилирования ДНК крови. Алгоритм основывается на 71 маркере метилирования ДНК, которые могут меняться в зависимости от окружающей человека среды, физических упражнений и диеты. Исследование с помощью этого алгоритма коллекции образцов крови собранных за 15 лет, показало что те, у кого эпигенетический возраст примерно на один год старше их хронологического возраста имеют на 6% больший риск заболеть раком в течение трех лет, а те, кто примерно на 2,2 года старше своего хронологического возраста имеют на 17% повышенный риск смерти от рака в течение пяти лет
Сопоставление данных по генотипу людей, предрасположенных к онкологическим заболеваниям, с профилем метилирования их ДНК позволило предположить, что примерно в 20% случаев наследуемого рака обнаруживается взаимосвязь между уровнем метилирования определенных локусов и полиморфизмами генов, связанных с риском заболевания раком. В частности, наблюдалась высоко значимая корреляция между уровнем метилирования CpG и экспрессией ключевых генов рака, таких как MYC, TERT, and TP63
Около трети всех солидных опухолей связано с мутацией гена KRAS или же с мутациями в путях связанных KRAS. KRAS, выключает фермент TET1 который способствует инактивации генов путем метилирования. TET1 катализирует начальную стадию активного железо и альфа-кетоглутарат зависимого деметилирования ДНК у млекопитающих - превращение 5-метилцитозина (5-MC) в 5-гидроксиметилцитозин (5-HMC) окислением 5-MC. Добавление в эти мутантные клетки TET1 активизирует гены-супрессоры опухоли что, как оказалось, достаточно, чтобы уменьшить аномальную пролиферацию. Вместе с тем достаточно инактивировать TET1, чтобы сделать эти клетки снова злокачественными, даже без KRAS
Важным биомаркером онкогенеза является гиперметилирование CpG островков внутри промотора гена ZNF154 (zinc-finger protein 154) Гиперметилирование ZNF154 наблюдалось у подавляющего большинства опухолевых клеток, но отсутствовало в нормальных клетках. Какую функцию в организме выполняет ген ZNF154 пока не ясно. Одновременно обычно наблюдается гипометилирование в двух геномных областях, связанных с Casp8 (каспаза-8) и VHL (супрессор опухолей Гиппеля-Линдау
Метилирование ДНК у насекомых
Уровень метилирования ДНК у излюбленного объекта генетиков Drosophila melanogaster очень низкий, что мешало исследованию его методами бисульфитного секвенирования. Такаяма с соавт. разработали высокочувствительный метод, который позволил обнаружить, что профиль метилирования последовательностей ДНК генома мухи очень сильно отличается от профиля метилирования генома человека, животных или растений. Метилирование генома у дрозофилы сосредоточено в определённых коротких последовательностях оснований (из 5 пар нуклеотидов), которые богаты CA и CT, но обеднены гуанином. Кроме того оно, как оказалось, не зависит от DNMT2 активности. Дальнейшее изучение метилирования ДНК у дрозофилы поможет выявлению возрастных изменений эпигенома.
Метилирование ДНК у растений
В последнее время произошел значительный прорыв в понимании процесса метилирования ДНК у растений, особенно у Arabidopsis thaliana. Основными метилтрансферазами ДНК у A. thaliana являются Met1, Cmt3 и Drm2, которые на уровне аминокислотной последовательности подобны вышеописанным метилтранферазам ДНК у млекопитающих. Drm2, предположительно, участвует как в de-novo метилировании ДНК, так и в поддержании метилирования на более поздних стадиях развития. Cmt3 и Met1, главным образом, выполняют функцию поддержания метилирования ДНК. Прочие метилтрансферазы ДНК также присутствуют у растений, но их функция пока не выяснена Считается, что специфичность метилтрансферазы в процессе метилирования ДНК модулируется при помощи РНК. Специфичные РНК-транскрипты транскрибируются с определенных участков матрицы — геномной ДНК. Эти РНК-транскрипты могут формировать двухцепочные молекулы РНК. Двухцепочные РНК, посредством регуляторных сигнальных путей, связанных либо с малыми интерферирующими РНК (siRNA), либо смикроРНК (miRNA), детерминируют локализацию метилтрансфераз ДНК на участках специфических нуклеотидных последовательностей в геном.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №14
Тема урока: Репликация повреждений ДНК
Цель урока: развивать и углублять знания по темерепликация повреждений ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Разнообразные повреждения ДНК могут возникать спонтанно либо под действием внешних факторов. Клетки нуждаются в высокоэффективных способах репарации, поскольку
целостность ДНК существенна для выживания клетки и ее нормального функционирования, а
повреждения возникают постоянно. ДНК, содержащая приблизительно 3х109 пар оснований (у
человека) и 2х1011 ковалентных связей, представляет собой огромную мишень для
различного рода повреждающих факторов. Исходя из известной энергии связей, можно
подсчитать, что ДНК типичной клетки каждый день претерпевает спонтанно около 10 000
депуринизаций (потеря А или G оснований), 500 депиримидинизаций (потеря С или Т
оснований) и 160 дезаминирований цитидина (превращение С в Т).
Основным типом экзогенных повреждений ДНК является димеризация пиримидиновых
оснований. Это происходит под влиянием ультрафиолетового света в эпидермисе и приводит
к образованию тимидиновых димеров (связанных циклобутановым кольцом) или тимидин-
цитидиновых димеров. Такие повреждения репарируются к исходным основаниям путем
фотореактивации с помощью фермента фотолиазы, использующего в качестве кофактора
реакции видимый свет. Кроме того, такие повреждения могут устраняться тем же способом,
что и объемные аддукты (описывается далее). Ряд экзогенных факторов приводит к
образованию ДНК-аддуктов, которые подразделяются на малые и объемные. Малые повреждения
включают метилирование и этилирование, вызываемые, например, нитрозоаминами (DEN) и
нитрозоамидами (MNNG), как обсуждалось ранее. Обычно сайт для такой модификации – это
О6-позиция гуанина и О4-позиция тимина. Эти атомы кислорода обычно находятся в кето-
конфигурации для правильного спаривания оснований. Однако этилирование фиксирует эти
атомы в енольной конфигурации, таким образом, дестабилизируя обычное углеродное
связывание между основаниями в противоположных цепях, что часто приводит к
возникновению точечной мутации. Эти аддукты могут быть удалены белком, первоначально
идентифицированном как метилтрансфераза. В каталитическом центре фермента имеется
остаток цистеина, на который переносится алкильная группа (метильная более часто, чем
этильная) с О6- и О4- Т. Впервые этот фермент был обнаружен у бактерий, где он
участвовал в метилировании ДНК. Обработка бактерий малыми дозами MNNG может защищать
их при последующих введениях больших доз, которые иначе могут оказаться летальными.
Такой метод репарации является «дорогим», поскольку фермент необратимо инактивируется
переносом алкильной группы. Таким образом, клетке необходимо затратить много энергии на
создание нового белка при удалении каждого аддукта таким способом. Алкилирующие
соединения также могут формировать аддукты с фосфатным остовом. Поскольку
образовавшиеся фосфотриэфиры являются нестабильными, может произойти гидролиз одной из
трех фосфо-кислородных связей. Если разрывается связь с дезоксирибозой, то это приводит
к разрыву последовательности. Если разрывы в каждой из цепей расположены рядом, то
это может привести к разрыву хромосомы. Пути снижения дестабилизирующего эффекта
алкилирующих соединений на хромосомы включают транспозицию, обмен сестринскими
хроматидами, разрушение или измельчение хромосом.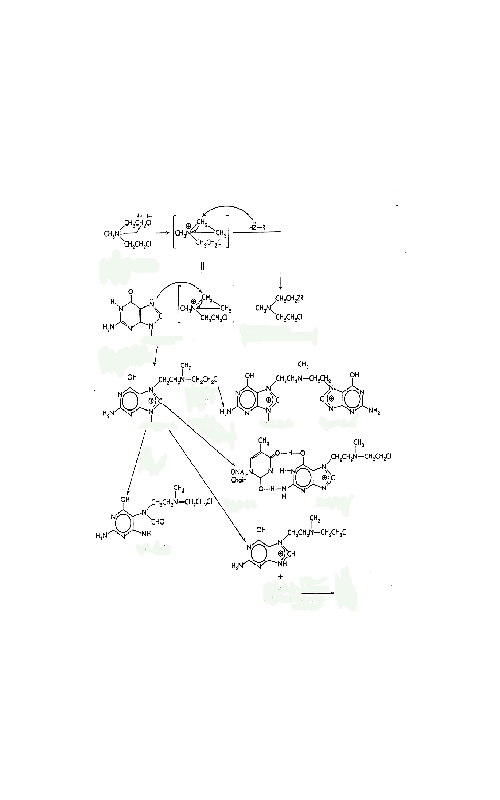
Механизм действия алкилирующих соединений
Рис. 1. Механизм действия алкилирующихсоединений
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №15
Тема урока: Повреждение оснований
Цель урока:развивать и углублять знания по теме повреждение оснований
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Полициклические ароматические углеводороды, гетероциклические амины, афлатоксины и
ряд других соединений могут формировать объемные аддукты, которые не удаляются простой
реакцией переноса. N2- и N7-позиции гуанина являются особенно чувствительными к атаке
электрофильного углевода таких соединений, а ионы нитрониума из аминов обычно атакуют
С8-позицию гуанина. В обоих случаях формирование C-N-связи предпочтительно. Независимо
от позиции, такой аддукт сильно нарушает комплементарное спаривание оснований между
цепями и, следовательно, нарушает спиральную структуру ДНК, причем эти искажения
узнаются аппаратом репарации. Удаление объемных аддуктов путем вырезания начинается с
внесения эндонуклеазного разрыва в той же самой цепи рядом с аддуктом. Затем с помощью
экзонуклеазной активности, удаляется 15-20 оснований, включая поврежденное, после чего
пробел застраивается ДНК-полимеразой и лигируется для удаления разрыва. С другой
стороны, поврежденное основание может удаляться репарирующей гликозилазой. Как и в
случае спонтанной депуринизации, утерянное основание узнается как структурное нарушение
и репарируется путем вырезания. Существует несколько типов аддуктов, которые не
удаляются так легко. Во-первых, кислородные радикалы могут приводить к связыванию
клеточных белков с ДНК. Например, ионизирующее излучение (включая космические лучи)
производят гидроксил-радикалы, которые ковалентно связывают белки друг с другом и с
ДНК. Полагают, что ряд металлов, таких как никель и хром, могут восстанавливаться
внутри клетки. В ходе этих процессов могут вырабатываться высоко реакционноспособные
разновидности кислорода, которые повреждают мембраны, белки и ДНК. Модифицированные
основания ДНК могут быть использованы в качестве маркеров окислительных процессов в
клетке или окислительного стресса. Второй тип трудно репарируемых ДНК-аддуктов – это
образование поперечных сшивок между цепями ДНК, так называемые «кросслинки».
Бифункциональные агенты, которые вызывают такие нарушения, используются в
химиотерапии рака, например, циклофосфамиды. Опасность этого типа повреждений состоит
не только в разрушении нормальных водородных связей, но и в том, что затрудняется
отделение двух цепей ДНК в ходе репликации. Другой класс соединений, вызывающих
поперечные сшивки, представляет псорален и его производные, которые используются для
экспериментального лечения псориаза. В целом, под действием таких соединений возможны
как внутрицепочечные, так и межцепочечные поперечные сшивки.
Кроме точечных мутаций, могут иметь место хромосомные сшивки, разрывы и сдвиг
рамки считывания. Различные химические соединения, типа бромистого этидия (который
используется для визуализации ДНК в ходе гель-электрофореза) и акридина, встраиваются
между основаниями и искажают двойную цепь. Во время репликации происходят ошибки в
работе полимеразного комплекса, приводящие к вставке или делеции оснований. Если такая
ошибка произошла в кодирующей области для какого-либо белка, происходит мутация со
сдвигом рамки, т. е. изменяется рамка трансляции и считывание всех аминокислот,
кодируемых после сайта мутации. В целом, последствия таких мутаций более серьезны, чем
последствия точечных мутаций. Замена единственной аминокислоты может быть критична, но
чаще всего нет. Кроме того, приблизительно 1/3 точечных мутаций (обычно в третьей
позиции кодона) не приводит к аминокислотной замене. Однако сдвиг рамки может привести
к замене большого числа аминокислот, часто приводящей к денатурации или преждевременной
терминации белковой цепи.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №16
Тема урока: Преждевременная терминация белковой цепи
Цель урока:развивать и углублять знания по теме преждевременная терминация белковой цепи
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема
Повреждения ДНК имеют разнообразные вредные последствия. Клетки,
находящиеся в состоянии покоя, имеют больше шансов на репарацию повреждений и,
следовательно, могут избегать серьезных трудностей. Если геном не может быть
репарирован, клетки могут быть уничтожены, когда войдут в стадию репликации.
Инактивация генов, кодирующих определенные «критические» белки, может предотвратить
репликацию, совместно или нет со смертью клетки, снизить скорость клеточного роста,
изменить выживаемость. Однако, в редких случаях рост клетки, напротив, стимулируется.
За последние 50 лет стало известно, что повреждения ДНК ассоциированы с неоплазией.
Известно, что хромосомные транслокации и даже отдельные точечные мутации способны
привести к активации онкогена, а инактивация генов раковых супрессоров дает возможности неконтролируемого клеточного роста. Поэтому для анализа потенциальных канцерогенов
разрабатываются специальные тесты, с помощью которых оцениваются повреждения ДНК. Несмотря на это, защитные пути, существующие в клетках человека, не
воспроизводятся полностью в этом тесте. Когда тест Эймса впервые был разработан и
популяризован, 90% соединений, дающих позитивную реакцию в этом тесте, оценивалось как канцерогены для животных. По настоящим оценкам эта цифра составляет приблизительно 60% (соответствие между крысиными и мышиными канцерогенами оценивается как приблизительно 70%). Несмотря на это, тест привлекателен из-за его низкой стоимости и быстроты выполнения. Некоторые исследователи предполагают, что более точно предсказать канцерогенность соединения можно с использованием нескольких краткосрочных тестов.
Например, подразумевается, что соединение является потенциальным мутагеном, если оно
дает положительный ответ на бактериях, клетках дрозофилы и животных, а также вызывает
высокий уровень обмена между сестринскими хроматидами. Интересно, что увеличение
количества тестов лишь незначительно улучшает результаты самого по себе теста Эймса.
Ранние обзоры по мутагенности с привлечением теста Эймса и последовательный анализ с
использованием различных технологий показали, что мы действительно окружены мутагенами: многие продукты (пережаренное мясо) и другие продукты потребления (краски для волос), ультрафиолетовый свет, радон в болотном газе, космические лучи, количество которых удваивается при авиа перелетах на большой высоте. Таким образом, сохранение нашего здоровья напрямую зависит от эффективности процессов репарации ДНК. К сожалению, для индивидуумов, дефицитных по некоторым ферментам, важность репарации еще более усиливается. Например, при синдроме пигментации ксеродермы (Хeroderma pigmentosium syndrome) репарация повреждений от ультрафиолета нарушается. Такие люди вынуждены избегать солнечного света, у них с высокой частотой развивается рак кожи. Согласно последним исследованиям репарация настолько важна, что некоторые ее пути являются встроенными в процесс репликации.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №17
Тема урока: Строение и функции хромосом
Цель: развивать и углублять знания по теместроение и функции хромосом
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.Организационный момент: проверка готовности учащихся к уроку
Новая
тема:
Хромосомы — структуры клетки,
хранящие и передающие наследственную информацию. Хромосома состоит
из ДНК и белка. Комплекс белков, связанных с ДНК, образует
хроматин. Белки играют важную роль в упаковке молекул ДНК в
ядре.ДНК в хромосомах упакована таким образом, что умещается в
ядре, диаметр которого обычно не превышает 5 мкм
(5-10- 4 см). Упаковка ДНК
приобретает вид петельной структуры, похожей на хромосомы
типаламповых щеток амфибий или политенных хромосом насекомых. Петли
поддерживаются с помощью белков, которые узнают определенные
последовательности нуклеотидов и сближают их. Строение хромосомы
лучше всего видно в метафазе митоза.Хромосома представляет собой
палочковидную структуру и состоит из двух сестринских хроматид,
которые удерживаются центромерой в области первичной перетяжки.
Каждая хроматид а построена из хроматиновых петель. Хроматин не
реплицируется. Реплицируется только ДНК.
Рис. 1. Строение и репликация хромосомы
С началом репликации ДНК синтез РНК прекращается. Хромосомы могут находиться в двух состояниях: конденсированном (неактивном) и деконденсированном (активном).Диплоидный набор хромосом организма называют ка-риотипом. Современные методы исследования позволяют определить каждую хромосому в кариотипе. Для этого учитывают распределение видимых под микроскопом светлых и темных полос (чередование AT и ГЦ-пар) в хромосомах, обработанных специальными красителями. Поперечной исчер-ченностью обладают хромосомы представителей разных видов. У родственных видов, например у человека и шимпанзе, очень сходный характер чередования полос в хромосомах. Каждый вид организмов обладает постоянным числом, формой и составом хромосом. В кариотипе человека 46 хромосом — 44 аутосомы и 2 половые хромосомы. Мужчины ге-терогаметны (ХУ), а женщины гомогаметны (XX). У-хромосо-ма отличается от Х-хромосомы отсутствием некоторых аллелей (например, аллеля свертываемости крови). Хромосомы одной пары называют гомологичными. Гомологичные хромосомы в одинаковых локусах несут аллельные гены.
Морфология хромосом лучше всего видна в клетке на стадии метафазы.
Хромосома состоит из двух палочкообразных телец - хроматид. Обе
хроматиды каждой хромосомы идентичны друг другу по генному составу.
Хромосомы дифференцированы по длине. Хромосомы имеют центромеру или
первичную перетяжку, две теломеры и два плеча. На некоторых
хромосомах выделяют вторичные перетяжки и спутники. Движение
хромосомы определяет Центромера, которая имеет сложное
строение.
ДНК центромеры отличается характерной последовательностью
нуклеотидов и специфическими белками. В зависимости от расположения
центромеры различают акроцентрические, субметацентрические и
метацентрические хромосомы.
Как говорилось выше, некоторые хромосомы имеют вторичные перетяжки.
Они, в отличие от первичной перетяжки (центромеры), не служат
местом прикрепления нитей веретена и не играют никакой роли в
движении хромосом. Некоторые вторичные перетяжки связаны с
образованием ядрышек, в этом случае их называют ядрышковыми
организаторами. В ядрышковых организаторах расположены гены,
ответственные за синтез РНК. Функция других вторичных перетяжек еще
не ясна. У некоторых акроцентрических хромосом есть спутники —
участки, соединенные с остальной частью хромосомы тонкой нитью
хроматина. Форма и размеры спутника постоянны для данной хромосомы.
У человека спутники имеются у пяти пар хромосом. Концевые участки
хромосом, богатые структурным гетерохроматином, называются
теломерами. Теломеры препятствуют слипанию концов хромосом после
редупликации и тем самым способствуют сохранению их целостности.
Следовательно, теломеры ответственны за существование хромосом как
индивидуальных образований.
Хромосомы, имеющие одинаковый порядок генов, называют
гомологичными. Они имеют одинаковое строение (длина, расположение
центромеры и т. д.). Негомологичные хромосомы имеют разный генный
набор и разное строение.
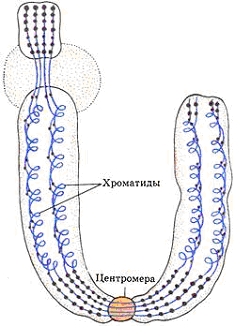
Исследование тонкой структуры хромосом
показало, что они состоят из ДНК, белка и небольшого количества
РНК. Молекула ДНК несет отрицательные заряды, распределенные по
всей длине, а присоединенные к ней белки — гистоны заряжены
положительно. Этот комплекс ДНК с белком называют хроматином.
Хроматин может иметь разную степень конденсации. Конденсированный
хроматин называют гетерохроматином, деконденсированный хроматин —
эухроматином. Степень деконденсации хроматина отражает его
функциональное состояние. Гетерохроматиновые участки функционально
менее активны, чем эухроматиновые, в которых локализована большая
часть генов. Различают структурный гетерохроматин, количество,
которого различается в разных хромосомах, но располагается он
постоянно в околоцентромерных районах. Кроме структурного
гетерохроматина существует факультативный гетерохроматин, который
появляется в хромосоме при сверхспирализации эухроматических
районов. Подтверждением существования этого явления в хромосомах
человека служит факт генетической инактивации одной Х-хромосомы в
соматических клетках женщины. Его суть заключается в том, что
существует эволюционно сформировавшийся механизм инактивации второй
дозы генов, локализованных в Х-хромосоме, вследствие чего, несмотря
на разное число Х-хромосом в мужском и женском организмах, число
функционирующих в них генов уравнено. Максимально конденсирован
хроматин во время митотического деления клеток, тогда его можно
обнаружить в виде плотных хромосом
Размеры молекул ДНК хромосом огромны. Каждая хромосома представлена
одной молекулой ДНК. Они могут достигать сотен микрометров и даже
сантиметров. Из хромосом человека самая большая — первая; ее ДНК
имеет общую длину до 7 см. Суммарная длина молекул ДНК всех
хромосом одной клетки человека составляет 170 см.
Несмотря на гигантские размеры молекул ДНК, она достаточно плотно
упакована в хромосомах. Такую специфическую укладку хромосомной ДНК
обеспечивают белки гистоны. Гистоны располагаются по длине молекулы
ДНК в виде блоков. В один блок входит 8 молекул гистонов, образуя
нуклеосому (образование, состоящее из нити ДНК, намотанной вокруг
октамера гистонов). Размер нуклеосомы около 10 нм. Нуклеосомы имеют
вид нанизанных на нитку бусинок. Нуклеосомы и соединяющие их
участки ДНК плотно упакованы в виде спирали, на каждый виток такой
спирали приходится шесть нуклеосом. Так формируется структура
хромосомы. Наследственная информация организма строго упорядочена
по отдельным хромосомам. Каждый организм характеризуется
определенным набором хромосом (число, размеры и структура), который
называется кариотипом. Кариотип человека представлен двадцатью
четырьмя разными хромосомами (22 пары аутосом, Х- и Y-хромосомы).
Кариотип — это паспорт вида. Анализ кариотипа позволяет выявлять
нарушения, которые могут приводить к аномалиям развития,
наследственным болезням или гибели плодов и эмбрионов на ранних
стадиях развития.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №18
Тема урока: Организация генетического материала
Цель урока:развивать и углублять знания по темеорганизация генетического материала
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
-
Код триплетен. В состав РНК входят 4 нуклеотида: А, Г, Ц, У. Если бы мы пытались обозначить одну аминокислоту одним нуклеотидом, то 16 из 20 аминокислот остались бы не зашифрованы. Двухбуквенный код позволил бы зашифровать 16 аминокислот (из четырех нуклеотидов можно составить 16 различных комбинаций, в каждой из которых имеется два нуклеотида) . Природа создала трехбуквенный, или триплетный, код. Это означает, что каждая из 20 аминокислот зашифрована последовательностью трех нуклеотидов, называемых триплетом или кодоном. Из 4 нуклеотидов можно создать 64 различные комбинации по 3 нуклеотида в каждой (4*4*4=64). Этого с избытком хватает для кодирования 20 аминокислот и, казалось бы, 44 кодона являются лишними. Однако это не так.
2. Код вырожден. Это означает, что каждая аминокислота шифруется более чем одним кодоном (от двух до шести) . Исключение составляют аминокислоты метионин и триптофан, каждая из которых кодируется только одним триплетом. Тот факт, что метионин кодируется одним триплетом АУТ, имеет особый смысл, который вам станет понятен позже.
3. Код однозначен. Каждый кодон шифрует только одну аминокислоту. У всех здоровых людей в гене, несущем информацию о бета-цепи гемоглобина, триплет ГАА или ГАГ, стоящий на шестом месте, кодирует глутаминовую кислоту. У больных серповидноклеточной анемией второй нуклеотид в этом триплете заменен на У. Как видно из таблицы, триплеты ГУА или ГУГ, которые в этом случае образуются, кодируют аминокислоту валин. К чему приводит такая замена, вы уже знаете из раздела о ДНК .
4. Между генами имеются "знаки препинания". В печатном тексте в конце каждой фразы стоит точка. Несколько связанных по смыслу фраз составляют абзац. На языке генетической информации таким абзацем являются оперон и комплементарная ему и-РНК. Каждый ген в опероне кодирует одну полипептидную цепочку - фразу. Так как в ряде случаев по матрице и-РНК последовательно создается несколько разных полипептидных цепей, они должны быть отделены друг от друга. Для этого в генетическом коде существуют три специальные триплета - УАА, УАГ, УГА, каждый из которых обозначает прекрдщение синтеза одной полипептидной цепи. Таким образом, эти триплеты выполняют функцию знаков препинания. Они находятся в конце каждого гена. Внутри гена нет "знаков препинания". Поскольку генетический код подобен языку, разберем это свойство на примере такой составленной из триплетов фразы: жил был кот тих был сер мил мне тот кот. Смысл написанного понятен, несмотря на отсутствие "знаков препинания. Если же мы уберем в первом слове одну букву (один нуклеотид в гене) , но читать будем также тройками букв, то получится бессмыслица: илб ылк отт ихб ылс ерм илм нет отк от Нарушение смысла возникает и при выпадении одного или двух нуклеотидов из гена. Белок, который будет считываться с такого испорченного гена, не будет иметь ничего общего с тем белком, который кодировался нормальным геном.
5. Код универсален. Генетический код един для всех живущих на Земле существ. У бактерий и грибов, пшеницы и хлопка, рыб и червей, лягушки и человека одни и те же триплеты кодируют одни и те же аминокислоты..
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №19
Тема урока: Способ записи генетической информации в молекуле ДНК. Биологический код и его свойства
Цель урока:развивать и углублять знания по темес пособ записи генетической информации в молекуле ДНК. Биологический код и его свойства
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Первично все многообразие жизни обусловливается разнообразием белковых молекул, выполняющих в клетках различные биологические функции. Структура белков определяется набором и порядком расположения аминокислот в их пептидных цепях. Именно эта последовательность аминокислот в пептидах зашифрована в молекулах ДНК с помощью биологического (генетического) кода. Относительная примитивность структуры ДНК, представляющей чередование всего лишь четырех различных нуклеотидов, долгое время мешала исследователям рассматривать это соединение как материальный субстрат наследственности и изменчивости, в котором должна быть зашифрована чрезвычайно разнообразная информация.
В 1954 г. Г. Гамовым было высказано предположение, что кодирование информации в молекулах ДНК должно осуществляться сочетаниями нескольких нуклеотидов. В многообразии белков, существующих в природе, было обнаружено около 20 различных аминокислот. Для шифровки такого их числа достаточное количество сочетаний нуклеотидов может обеспечить лишь триплетный код, в котором каждая аминокислота шифруется тремя стоящими рядом нуклеотидами. В этом случае из четырех нуклеотидов образуется 43 = 64 триплета. Код, состоящий из двух нуклеотидов, дал бы возможность зашифровать только 42 = 16 различных аминокислот.
Полная расшифовка генетического кода проведена в 60-х гг. нашего столетия. Из 64 возможных триплетов ДНК 61 кодирует различные аминокислоты; оставшиеся 3 получили название бессмысленных, или «нонсенс-триплетов». Они не шифруют аминокислот и выполняют функцию знаков препинания при считывании наследственной информации. К ним относятся АТТ, АЦТ, АТЦ.
Обращает на себя внимание явная избыточность кода, проявляющаяся в том, что многие аминокислоты шифруются несколькими триплетамию. Это свойство триплетного кода, названное вырожденностью, имеет очень важное значение, так как возникновение в структуре молекулы ДНК изменений по типу замены одного нукле-отида в полинуклеотидной цепи может не изменить смысла триплета. Возникшее таким образом новое сочетание из трех нуклеотидов кодирует ту же самую аминокислоту.
В процессе изучения свойств генетического кода была обнаружена его специфичность. Каждый триплет способен кодировать только одну определенную аминокислоту. Интересным фактом является полное соответствие кода у различных видов живых организмов. Такая универсальность генетического кода свидетельствует о единстве происхождения всего многообразия живых форм на Земле в процессе биологической эволюции.
Незначительные отличия генетического кода обнаружены в ДНК митохондрий некоторых видов. Это не противоречит в целом положению об универсальности кода, но свидетельствует в пользу определенной дивергентности в его эволюции на ранних этапах существования жизни. Расшифровка кода в ДНК митохондрий различных видов показала, что во всех случаях в митохондриальных ДНК отмечается общая особенность: триплет АЦТ читается как АЦЦ, и поэтому из нонсенс-триплета превращается в шифр аминокислоты триптофана.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №20
Тема урока: Оперонная организация генетического материала у бактерий.
Цель урока:развивать и углублять знания по темеоперонная организация генетического материала бактерий
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Компонент промоторов у кишечной палочки — так называемый бокс (последовательность) Прибнова:в) Что касается участков связывания регуляторных белков, то у бактерий их называют операторами. Они располагаются после промотора (рис.1). При определенных условиях с оператором связывается специфический белок-репрессор, и это блокирует «прочтение» РНК-полимеразой соответствующей группы генов. У эукариот регуляцию «прочтения» генов осуществляют не только белки-репрессоры, но и белки-активаторы — т. н. транскрипционные факторы (рис.1).
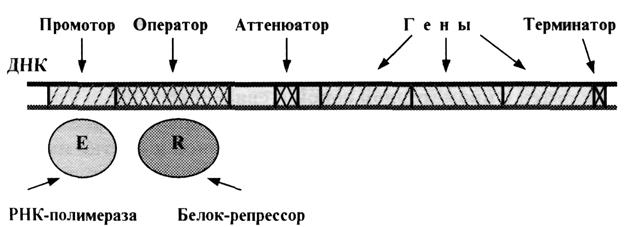
Рис. 1. Функциональные отделы в ДНК бактерий
К последним относятся уже упоминавшиеся общие факторы транскрипции, необходимые для связывания РНК-полимеразы с промотором. Эти факторы имеются во всех клетках и необходимы для «прочтения» любого функционирующего гена. Другие транскрипционные факторы повышают активность только определенных генов, и локусы ДНК, связывающие такие факторы, называются энхансерами. Энхансеры могут располагаться достаточно далеко от регулируемого гена: на расстоянии нескольких тысяч нуклеотидных пар. Как же связывание с ними транскрипционных факторов может стимулировать активность гена?Видимо, дело в сложной пространственной организации ДНК. Последняя образует петли, благодаря чему энхансеры сближаются с промоторной зоной и связанные с ними факторы влияют на активность транскрипционного комплекса (рис.2).
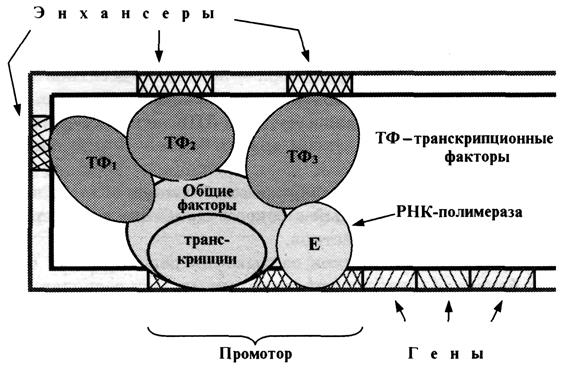
Рис.2. Функциональные отделы в ДНК эукариот
Причем, для некоторых ключевых генов в клетке имеется сразу несколько энхансеров, достаточно удаленных друг от друга. Следовательно, все они в результате изгибов ДНК должны собираться примерно в одном месте пространства.
Что же касается белков-репрессоров, то они при вхождении в состав транскрипционных комплексов не повышают, а понижают их активность.
Часто используется также термин «супрессоры» — так называются факторы (обычно это белки), которые угнетают тот или иной клеточный процесс. Например, опухолевые супрессоры — регуляторные белки, препятствующие опухолевому росту. Очевидно, по механизму своего действия они могут быть как репрессорами, так и транскрипционными факторами.
г) В ДНК могут содержаться короткие локусы, служащие сигналами об окончании (терминации) транскрипции ДНК.
У бактерий в ряде случаев участки с такой функцией находятся перед группой совместно регулируемых генов. Это т. н. аттенюаторы (см. рис.1). Терминирующие же участки, располагающиеся после генов, называются терминаторами.
В одних условиях транскрипция прекращается на аттенюаторе (гены не считываются), в других условиях — на терминаторе (гены прочитываются).
У эукариот сигналы терминации более сложные: в отличие от бактериальных, они тоже транскрибируются РНК-полимеразой, и только затем последняя завершает свою работу.
У бактерий гены ферментов, катализирующих ряд последовательных реакций, нередко объединяются в одну структурно-функциональную единицу — оперон (рис.3).
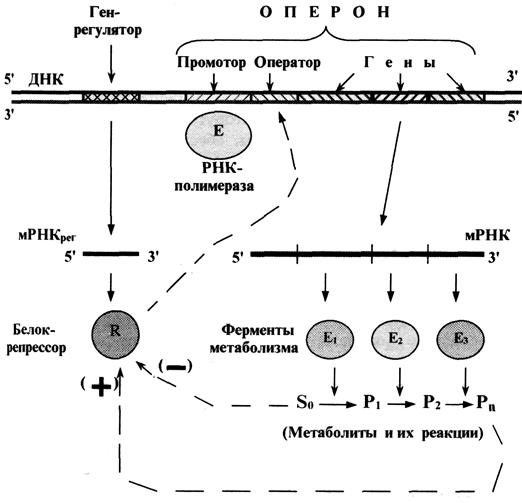
Рис.3. Схема функционирования оперона
Помимо указанных генов, в оперон входят промотор (место связывания РНК-полимеразы) и оператор (место связывания белка-репрессора).Сам же белок-репрессор кодируется специальным геном-регулятором, который в состав оперона обычно не входит. Для разных оперонов существуют разные белки-репрессоры и, соответственно, разные гены-регуляторы. Хотя не исключено, что какие-то белки-репрессоры контролируют активность сразу нескольких оперонов.Принцип регуляции активности оперона состоит в том, что на сродство белка-репрессора к оператору могут влиять метаболиты той цепи реакций, ферменты которой кодируются данным опероном. В связи с этим различают опероны двух типов.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №21
Тема урока: Конститутивные гены и белки
Цель урока:развивать и углублять знания по темеконститутивные гены и белки
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Подобным образом регулируется активность далеко не всех генов.
Многие гены являются конститутивными, т. е. все время находятся в активном состоянии, и скорость их транскрипции не подвергается избирательной регуляции (хотя и может меняться в связи с изменением общего состояния клетки). Такие гены кодируют белки (в т. ч. ферменты), постоянно необходимые клетке.Эти белки (как и гены) тоже называются конститутивными. Для кишечной палочки к подобным белкам относятся, например, ферменты метаболизма глюкозы.Но скорость транскрипции различных конститутивных генов может не совпадать. Этому может быть несколько причин.
а) Одна из них — различное сродство промоторов к РНК-полиме-разе, или, как говорят, различная «сила» промоторов.
У некоторых конститутивных генов промотор имеет высокое сродство к РНК-полимеразе (т. е. является «сильным»). Поэтому здесь молекулы РНК-полимеразы связываются с промотором часто, отчего за единицу времени образуется большое количество копий мРНК.
У промоторов других генов невысокое сродство к РНК-полимеразе. Соответственно, молекулы этого фермента связываются редко, и образуется гораздо меньше копий мРНК.
б) Вторая возможная причина заключается в самой РНК-полимеразе.В разных условиях существования бактериальной клетки образуются сигма-факторы, узнающие разные промоторы. Так, особые сигма-факторы соответствуют обычным условиям, азотному голоданию, тепловому шоку и состоянию споруляции. В каждом из этих случаев РНК-полимераза связывается с промоторами одних генов и не связывается с промоторами других генов.
Таким образом, у бактерий используются два принципиальных способа регуляции экспрессии генов:
- регуляция связывания РНК-полимеразы с промоторами (за счет природы промотора, природы сигма-фактора РНК-полимеразы, а также, как мы увидим на примере лактозного оперона, специального белка САР);
- регуляция перемещения связавшейся РНК-полимеразы от промотора к собственно генам (при «чисто» опероном механизме регуляции).Лактозный оперон интересен тем, что здесь в одной регуляторной системе используются сразу оба только что названных принципиальных подхода — регуляция и связывания РНК-полимеразы, и ее перемещения через оператор.Причем, существуют и другие опероны со сходным принципом организации. Примечательно, что все они являются индуцибельными и все контролируют распад (катаболизм) поступающих извне питательных веществ. В то же время не для всех таких веществ имеется оперонный принцип регуляции, примером чему, как отмечалось выше, служит глюкоза.
Рассмортим лактозный оперон (рис.1).
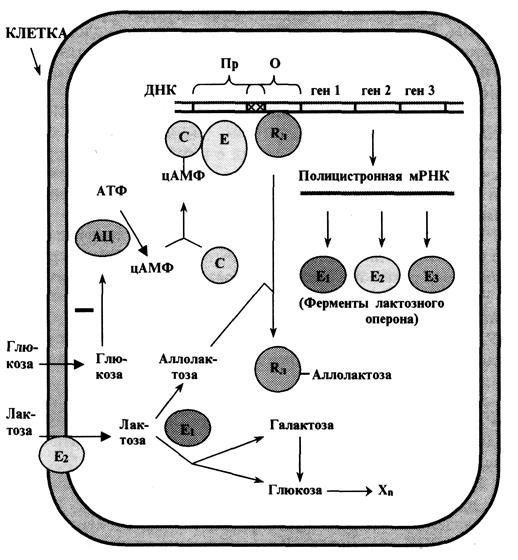
Рис.1. Схема лактозного оперона
Пр- промотор, О – оператор, С- САР (белковый активатор катаболизма), Е- РНК-полимераза, Rл – репрессор лактозного оперона, Е1- b-галактозидаза, Е2- пермеаза, Е3- трансацетилаза, АЦ- аденилатциклаза
Он включает три гена. Из них первые два кодируют ферменты утилизации лактозы: пермеазу и b-галактозидазу.
Пермеаза необходима для проникновения лактозы из внешней среды в клетку. Заметим, что даже при «выключенном» опероне имеется небольшое количество пермеазы. Поэтому при появлении во внешней среде лактозы какое-то количество ее может проникать внутрь и оказывать сигнальное воздействие на лактозный оперон.
Второй фермент — b-галактозидаза — катализирует распад лактозы на глюкозу и галактозу. Последние далее вступают в катаболические превращения, обеспечиваемые конститутивными ферментами. При «выключенном» опероне имеется небольшая активность и этого фермента. Это важно потому, что параллельно с основной реакцией (гидролизом лактозы) происходит и побочная — изомеризация лактозы в аллолактозу (где галактоза и глюкоза соединены не 1,4-, а 1,6-гликозидной связью). И именно аллолактоза, а не лактоза, служит регулятором активности оперона.
Конкретно, аллолактоза, появляясь в клетке при наличии во внешней среде лактозы, связывается с лактозным репрессором. Этот белок кодируется специальным геном, имеет 4 субъединицы и в отсутствие аллолактозы связывается с оператором лактозного оперона, блокируя транскрипцию генов оперона. Аллолактоза же, связываясь с репрессором, снижает его сродство к оператору, что деблокирует гены. Таким образом, при появлении вне клетки лактозы происходит активация лактозного оперона и интенсивное образование в клетке ферментов утилизации лактозы.
Но это имеет место только тогда, когда во внешней среде нет глюкозы. Если же там достаточно глюкозы, то биологического смысла в использовании лактозы уже нет. В соответствии с этим, глюкоза препятствует активации лактозного оперона даже в присутствии больших количеств лактозы.
Достигается это путем влияния на связывание РНК-полимеразы с промотором. Дело в том, что промоторная область в лактозном опероне (и в сходных с ним оперонах) шире, чем обычно, и способна связывать не только РНК-полимеразу, но и особый белок — CAP (catabolite gene activator protein), белковый активатор катаболизма.В отсутствие САР РНК-полимераза очень плохо связывается с промотором лактозного оперона, а САР изменяет структуру промотора, резко повышая его сродство к РНК-полимеразе. По существу, САР играет у бактерий примерно ту же роль, что общие факторы транскрипции у эукариот. Только САР необходим для деятельности лишь некоторых оперонов, тогда как общие факторы транскрипции — для функционирования любого гена эукариот.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №22
Тема урока: Количественные особенности генома эукариот
Цель урока:развивать и углублять знания по темеколичественные особенности генома эукариот
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Главная количественная особенность генетического материала эукариот наличие избыточной ДНК. Этот факт легко выявляется при анализе отношения числа генов к количеству ДНК в геноме бактерий и млекопитающих.
Нуклеотидные последовательности в геноме эукариот
В конце 60-х годов работами американских ученых Р. Бриттена, Э. Дэвидсона и других была открыта фундаментальная особенность молекулярной структуры генома эукариот - нуклеотидные последовательности разной степени повторяемости. Это открытие было сделано с помощью молекулярно-биологического метода изучения кинетики ренатурации денатурированной ДНК. Различают следующие фракции в геноме эукариот.Уникальные, т.е. последовательности, представ-ленные в одном экземпляре или немногими копиями. Как правило, это цистроны структурные гены, кодирующие белки. Низкочастотные повторы последовательности, повторяющиеся десятки раз.
Промежуточные, или среднечастотные, повторы - последовательности, повторяющиеся сотни и тысячи раз. К ним относятся гены рРНК (у человека 200 на гаплоидный набор, у мыши - 100, у кошки - 1000, у рыб и цветковых растений - тысячи), тРНК, гены рибосомных белков и белков-гистонов.
Высокочастотные повторы, число которых достигает 10 миллионов (на геном). Это короткие (~ 10 пн) некодирующие последовательности, которые входят в состав прицентромерного гетерохроматина.ДНК мышей на 70% состоит из уникальных последовательностей, на 20% - из низкочастотных и среднечастотных повторов, на 10% - из высокочастотных.Повторы образуют так называемые семейства, под которыми понимают совокупность последовательностей, полностью или по большей части гомологичных друг другу.
Нередко из-за существенных различий в нуклеотидном составе высокочастотных повторов и остальной ДНК первые образуют при центрифугировании в градиенте плотности хлористого цезия так называемые сателлитные пики, которые имеют большую или меньшую плавучую плотность, чем остальная ДНК. Эта фракция генома пред-ставлена небольшим (10…15) числом семейств коротких (5…12 п.н.) повторов, образующих протяженные блоки. Внутри блоков группы повторов отдельных семейств могут чередоваться друг с другом, так что сателлитная ДНК имеет как бы лоскутную структуру. Гибридизация фракций высокочастотных последовательностей с ДНК непосредственно на препаратах хромосом позволила установить, что эта фракция генома локализована в районах конститутивного гетерохроматина, чаще всего прицентромерного или теломерного. Еще в 30-х годах было показано, что в генетическом отношении эти районы инертны, т. е. не содержат генов. В действительности столь малые после-довательности, составляющие сателлитную ДНК, не могут кодировать ничего, кроме олигопептидов. Более того, гетерохроматические районы не транскрибируются. Таким образом, в случае высокочастотных последовательностей ДНК обнаруживается тождество молекулярной организации и генетических свойств хромосомной ДНК эукариот. Следует отметить, что эта фракция у огромного большинства видов занимает не более 10% генома. Близкие виды, например мышь и крыса, имеют совершенно различ-ные высокочастотные последовательности, у крысы их нуклеотидный состав не отличается от основной ДНК, тогда как геном мыши содержит четкий АТ-богатый сател-лит. Это означает, что высокочастотная ДНК способна к быстрым изменениям в ходе видообразования.
Остальные 90 % генома эукариот, его эухроматическая часть, построены по принципу чередования (интерсперсии) уникальных и повторяющихся последовательностей. Условно выделяют два основных типа интерсперсии, полу-чивших названия по тем видам, у которых они впервые были описаны: интерсперсия типа «ксенопус» (обнару-жена у шпорцевой лягушки Xenopus laevis) и типа «дрозофила» (впервые описана у плодовой мушки D. melanogaster). Примерно в 50 % генома Xenopus laevis уникальные последовательности из 800…1200 п.н. чередуются с повторяющимися, средний размер которых 300 п.н. В остальной части геномов типа «ксенопус» расстояния между соседними повторами значительно превышают 1…2 п.н. Структура генома типа «ксенопус» широко распространена, особенно среди жи-вотных. Млекопитающие и человек также относятся к этому типу организации генома. Особенность генома человека и других приматов составляют интерсперсные высокоча-стотные повторы длиной около 300 п.н. У человека эти повторы содержат сайт, разрезаемый ферментом рестрик-ции Alu I. Число Alu-подобных повторов в геноме человека достигает 5?105, а по некоторым данным, даже 106.
Alu-подобные последовательности приматов представ-ляют собой частичные дупликации (удвоения) последо-вательности В1 в геноме грызунов, впервые описанной Г. П. Георгиевым и его сотрудниками.У D. melanogaster параметры интерсперсии резко от-личаются от видов с типом генома «ксенопус»: повторяю-щиеся последовательности длиной 5600 п.н. чередуются с уникальными, длина которых не менее 13000 п.н. Инте-ресно отметить, что у домашней мухи геном устроен по типу «ксенопус». Этот факт прямо указывает на то, что в ходе эволюции возможны очень быстрые преобразования характера чередования последовательностей и в эухроматической части генома. Птицы по параметрам интерс-персии занимают промежуточное положение между типом «ксенопус» и типом «дрозофила». Как показывают резуль-таты исследований последних лет, многие виды животных и растений по организации генома не могут быть строго отнесены ни к тому, ни к другому типу. Так, в геномах мле-копитающих встречаются длинные повторы - в несколько тысяч пар нуклеотидов, в геномах лилейных до 90% ДНК может быть представлено повторяющимися последова-тельностями. Например, геном гороха не содержит уни-кальных последовательностей, превышающих по длине 300 п.н.
Другая особенность повторяющихся последовательно-стей в геномах эукариот - инвертированные повторы, или палиндромы (см. ниже). В условиях ренатурации они практически мгновенно формируют дуплексные структуры. По существу, палиндромы представляют собой часть про-межуточных повторов. Однако некоторые высокочастот-ные повторы в эухроматической части генома, например члены Alu-семейств, могут встречаться как в прямом, так и в инвертированном положении. Иногда между инвер-тированными повторами вклиниваются другие последо-вательности.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №23
Тема урока: Конститутивные гены и белки.
Цель урока:развивать и углублять знания по теме конститутивные гены и белки
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
У эукариот описаны некоторые особенности структуры ДНК, обусловленные спецификой нуклеотидного состава отдельных последовательностей. Так, встречаются расположенные в одной цепи блоки нуклеотидов, состоящих из нескольких десятков пуринов. Тогда комплементарная часть в другой цепи ДНК будет представлена пиримидинами. Подобные последовательности названы полипуриновыми (полипиримидиновыми) блоками.
Другой вид гетерогенности связан с неравномерностью содержания по длине ДНК пар аденин-тимин (АТпары) и гуанин-цитозин (ГЦ-пары). Так, в геноме дрозофилы периодически встречаются последовательности длиной примерно в 100 п. н., на 85 % состоящие из АТпар. По скольку аденин связан с тимином двумя водородными связями, а гуанин с цитозином тремя, дестабилизи-рующие ДНКвоздействия будут легче инициировать расплетание дуплексов ДНК с образованием участков частич-ной денатурации в АТ-богатых областях. По-этому последние рассматриваются в качестве сайтов ини-циации элементарных генетических процессов: реплика-ции, транскрипции и рекомбинации.
В заключение отметим, что перечисленные выше осо-бенности молекулярной структуры ДНК эукариот не были предсказаны ни классической генетикой (за исключением, пожалуй, свойств гетерохроматина), ни моделью двойной спирали Уотсона и Крика. Они были раскрыты при иссле-довании структуры геномов различных эукариотических организмов физико-химическими методами. Функции большинства повторяющихся и уникальных последова-тельностей пока не определены. Однако вполне вероятно, что сама по себе молекулярная структура ДНК эукариот служит зеркалом генетической регуляции и эволюции выс-ших животных и растений.
Хроматин и компактизация хромосом
Основой генетического аппарата эукариот являются линейные хромосомы. В основе хромосомы лежит линейная двуспиральная правозакрученная молекула ДНК, связанная со специфическими белками-гистонами. Известно 5 типов гистонов: Н1, Н2А, Н2В, НЗ, Н4. В ядрах эритроцитов птиц Н1 частично замещается на Н5. У дрожжей отсутствует Н1, а у некоторых видов хламидомонад гистоны вообще не обнаружены. Гистоны отсутствуют также у мезокариот (одноклеточных организмов - динофлагеллят, ночесветок), в сперматозоидах некоторых рыб. Отсутствие гистонов в перечисленных случаях рассматривается как вторичное явление. Гистоны Н2 - Н4 эволюционно устойчивы: из 102 аминокислот Н4 наблюдаются различия лишь по 1-2 аминокислотам у высших растений, рыб и млекопитающих. Гистон Н1 весьма вариабелен, и даже в тканях одного организма встречается 3 - 6 вариантов этого белка.
Гистоны Н2 - Н4 образуют белковое ядро из 8 полипептидов (каждый гистон повторяется 2 раза). Вокруг этого ядра уложен участок ДНК длиной 140 пн, образующий 1,75 витка по периферии. Такая структура называется нуклеосома. Отдельные нуклеосомы это дисковидные частицы диаметром около 10 нм. Закручивание ДНК вокруг нуклеосомы уменьшает ее длину в семь раз. Участки ДНК между нуклеосомами длиной 15…10 пн называются линкерами (связками). Структура линкеров стабилизируется с помощью гистона Н1.
Последовательность нуклеосом образует или еще одну спираль диаметром 25…20 нм (соленоид), или последовательность нуклеосомных группировок нуклеомеров. Эти высшие структуры образуют петли или домены. Кон-денсация ДНК в структуре соленоида дополнительно (к нуклеосомному уровню) уменьшает ее длину в шесть раз. В интерфазных хромосомах путем еще одного цикла конденсации соленоиды образуют полые трубочки диаметром 200 нм, что уменьшает длину ДНК еще в 18 раз.
Описанная структура хромосом у эукариот обеспечивает их устойчивость и недоступность основной массы ДНК для химических мутагенов. При транскрипции, т.е. синтезе РНК, и репликации происходит деспирализация хромосом, что обеспечивает возможность контакта определенных участков ДНК с ДНКполимеразой или РНК-полимеразой.
Определенные участки хромосом в ядре тесно связаны с ядерной мембраной. Всегда связаны с мембраной концевые (теломерные) участки и некоторые другие (интерстициальные) участки. Такие связи обеспечивают определенную структуру ядра и защищают хромосомы от разрушения ферментами нуклеазами. Ю. С. Ченцовым и его сотрудниками открыта специальная частица, обес-печивающая связь хроматина с ядерной мембраной, которую предложено называть анкоросомой (якорной частицей).
В метафазе вследствие дальнейшей конденсации возникает большая образованная дезоксинуклеопротеидом спираль диаметром около 600 нм. В результате строго упорядоченной иерархии спиралей, в основе которой лежит нуклеосома, в митозе и мейозе хромосомы эукариот совершают цикл компактизации декомпактизации.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №24
Тема урока: Особенности репликации эукариотических хромосом
Цель урока:развивать и углублять знания по тема особенности репликации эукариотических хромосом
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Особенности репликации эукариотических хромосом
Как и у прокариот, репликация ДНК в клетках эукарио-тических организмов осуществляется полуконсервативно, о чем свидетельствует распределение Нитимидиновой метки по сестринским хроматидам во втором и последующих митозах после инкубации клеток с радиоактив-ными предшественниками. Выяснено, что репликация у эукариот носит двунаправленный характер.
Принцип регуляции репликации ДНК эукариот в онтогенезе был открыт английским цитогенетиком Г. Кэлланом в 1972 г. С помощью радиоавтографии меченных 3Н-тимидином волокон ДНК, полученных из клеток животных непосредственно на предметном стекле, Кэллан определил скорость репликации и расстояние между сосед-ними центрами инициации в S-фазе соматических и эмбриональных клеток.
По первому показателю между этими типами клеток больших различий не наблюдалось. Число сайтов инициа-ции репликации было максимальным в раннем эмбриогенезе, минимальным в предмейотической S-фазе и промежуточным в соматических клетках. Эти данные в принципе были подтверждены позднее прямым электронномикроскопическим анализом реплицирующейся ДНК из дробщихся яиц дрозофилы. Таким образом, суть регуляции процесса репликации у эукариот заключается в измене-нии числа сайтов инициации репликации. Этот механизм позволяет увеличить продолжительность фазы S (а, сле-довательно, всего митотического цикла) с 3,5 мин (на ран-них стадиях дробления яиц дрозофилы) до десятков часов в предмейотической S-фазе. Упаковка ДНК и гистонов в нуклеосомы происходит в фазе S, поскольку гистоны синтезируются синхронно с репликацией ДНК.
Переключение генов у эукариот У эукариот опероны отсутствуют, и система управления активностью генов более сложная. Во-первых, у эукариот включаются не три гена (или чуть больше), а целые батареи генов. Во-вторых, регуляция активности генов происходит не за счет связывания оператора с белком репрессором, а за счет спирализации и деспирализации хромосом. В третьих, у эукариот регуляция работы генов происходит не по принципу «да-нет», а по принципу «больше меньше».
У прокариот регуляторные участки составляют примерно 5 % от всей ДНК, а у эукариот длина регуляторных участков соизмерима с общей длиной структурных генов. Регуляторные белки у эукариот влияют не только на работу генов в одной хромосоме, но и на активность функционально сходных генов в разных хромосомах. Например, - и -цепи гемоглобина кодируются генами, расположенными в разных хромосомах. Однако количество -цепей равно количеству -цепей. Промоторы и операторы у эукариот могут быть удалены от структурных генов на значительное расстояние.
У многоклеточных эукариот в ходе онтогенеза из исходной клетки развивается целостный организм. На разных этапах онтогенеза в разных тканях с разной интенсивностью экспрессируются разные гены. Активность генов у эукариот регулируется разнообразными эндо- и экзогенными факторами, в том числе, и гормонами. Способность исходной клетки реализовывать генетическую информацию в ходе клеточных делений и дифференцировки клеток называется тотипотентностью. У растений тотипотентны и оплодотворенные яйцеклетки, и почти все соматические клетки. У животных тотипотентна только зигота (а также некоторые клетки низших беспозвоночных). Поэтому методы клонирования животных основаны на пересадке ядер из соматических клеток в энуклеированные яйцеклетки (то есть яйцеклетки с убитым ядром).
Выключение генов может быть обратимым и необратимым. У животных существует два типа дробления зиготы: недетерминированное (дифференцировка клеток на поздних стадиях онтогенеза) и детерминированное (дифференцировка клеток на самых ранних этапах дробления зиготы). В первом случае можно пересадить ядро из клеток кишечного эпителия головастика в яйцеклетку с убитым с помощью ультрафиолетового облучения ядром. Из такой синтезированной клетки разовьется нормальная лягушка. Во втором случае клетки передней части бластодермы дрозофилы способны формировать только структуры передней части тела имаго, а клетки задней части бластодермы - только структуры задней части тела.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №25
Тема урока: Структура РНК
Цель урока:развивать и углублять знания
по теместруктура РНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нук-леотиды связаны между собой 3',5'-фосфодиэфирными связями. Концы полинуклеотидных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа 5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гидролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется.
Вторичная структура РНК
Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК.
Третичная структура РНК
Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удалёнными друг от друга, или связей между ОН-группами остатков рибозы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями.
Основные типы РНКВ цитоплазме клеток присутствуют 3 типа рибонуклеиновых кислот - транспортные РНК (тРНК), матричные РНК (мРНК) и рибосомальные РНК (рРНК). Они различаются по первичной структуре, молекулярной массе, конфор-мации, продолжительности жизни и, самое главное, по функциональной активности.
Транспортные РНК (тРНК)
Пространственную структуру любых тРНК, независимо от различий в последовательности нук-леотидов, описывают универсальной моделью "клеверного листа". В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним, в частности, относят участок, ответственный за связывание с аминокислотой на 3'-конце молекулы и антикодон - специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК.
В состав нуклеотидов тРНК входят минорные основания (в среднем 10-12 оснований на молекулу). Они представлены метилированными основаниями, изомерами и аналогами пиримидинов.
Минорные основания выполняют 2 функции: они делают тРНК устойчивыми к действию нук-леаз цитоплазмы и поддерживают определённую третичную структуру молекулы, так как не могут участвовать в образовании комплементарных
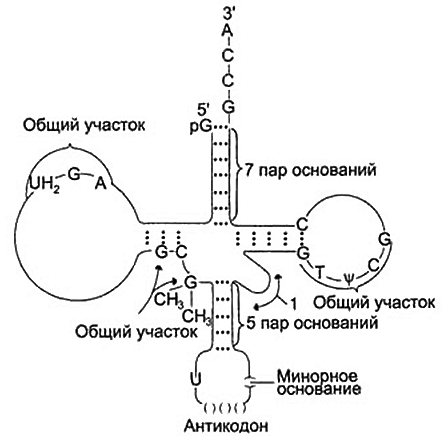
Рис. 1. Строение транспортных РНК.
Спирализованные участки обозначены на рисунке пунктиром; "общие участки" одинаковы у всех тРНК; 1 - петля переменного размера; UH2 (дигидроурацил), ψ (псевдоурацил) - минорные основания; антикодону всегда предшествует U (урацил), а после него всегда стоит минорное основание пар, и препятствуют спирализации определённых участков в полинуклеотидной последовательности тРНК.
Матричные РНК (мРНК)
Первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5'- и З'-концов. Так, на 5'- конце присутствует модифицированный нуклеотид 7-метилгуанозин-5'-трифосфат (кэп). Несколько десятков нуклеотидов отделяют кэп от инициирующего кодона, обычно это триплет -AUG-. За кодирующим участком следует один из терминирующих кодонов -UGA-, -UUA-, -UAG-. На 3'-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмонофосфатных остатков.
Рибосомальные РНК (рРНК)
Рибосомальные РНК имеют многочисленные спирализованные участки. Различают рРНК - 5S, 5,8S, 28S и 18S (S - коэффициент седиментации). Рибосомальные РНК содержат несколько

Рис. 2. Минорные основания тРНК.
модифицированных нуклеотидов, чаще всего это метилированные производные азотистых оснований или рибозы (2'-метилрибоза). рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №26
Тема урока: Синтез РНК.
Цель урока:развивать и углублять знания по темесинтез РНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: При включении гена
сначала происходит локальное расплетение ДНК и синтезируется
РНК-копия генетической программы. В результате сложных обработок ее
специальными белками получается матричная РНК (мРНК), которая и
является программой для синтеза белка. Эта РНК переносится из ядра
в цитоплазму клетки, где она связывается со специальными клеточными
структурами — рибосомами, настоящими молекулярными «машинами» для
синтеза белка. Белок синтезируется из активированных аминокислот,
присоединенных к особым транспортным РНК (т:РНК), причем каждая из
аминокислот присоединена к своей специфической тРНК. Благодаря тРНК
аминокислота фиксируется в каталитическом центре рибосомы, где она
«пришивается» к синтезируемой белковой цепи. Из рассмотренной
последовательности событий видно, что молекулы РНК играют ключевую
роль в декодировании генетической информации и биосинтезе
белка.
Чем больше углублялись в изучение различных биосинтетических
процессов, тем чаще обнаруживали ранее неизвестные функции РНК.
Оказалось, что кроме процесса транскрипции (синтеза РНК путем
копирования участка ДНК) в ряде случаев, наоборот, может
происходить синтез ДНК на РНК-матрицах. Этот процесс, названный
обратной транскрипцией, используют в ходе своего развития многие
вирусы, в том числе печально известные онкогенные вирусы и ВИЧ-1,
вызывающий СПИД.
Таким образом, выяснилось, что поток генетической информации не
является, как первоначально считалось, однонаправленным — от ДНК к
РНК. Роль ДНК как изначально главного носителя генетической
информации стала подвергаться сомнению. Тем более что многие вирусы
(гриппа, клещевого энцефалита и другие) вообще не используют ДНК в
качестве генетического материала, их геном построен исключительно
из РНК. А далее посыпались одно за другим открытия, которые
заставили совершенно по-другому взглянуть на РНК.
Все гены РНК делят на 3 группы – кодирует и-РНК, (Синтез белка – на них строится и-РНК), кодирует р-РНК, кодирует т-РНК.. У прокариот известно 7 генов, кодирующих р-РНК. Длина каждого такого гена около 5 тыс. нуклеотид. На таком гене сначала образ-ся незрелая р-РНК. В ней содержатся: несущие информацию ставки, информация о 3 видах р-РНК и о нескольких видах т-РНК. Созревание состоит в том, что вырезаются все ставки и цепи р- и т-РНК. Основная часть генов т-РНК одиночная. Часть т-РНК генов объединится в группы с генами р-РНК.
Транскрипция (от лат. transcriptio — переписывание) — процесс
синтеза РНК с использованием ДНК в качестве матрицы, происходящий
во всех живых клетках. Другими словами, это перенос генетической
информации с ДНК на РНК. Транскрипция катализируется ферментом
ДНК-зависимой РНК-полимеразой.
Инициация транскрипции — сложный процесс, зависящий от
последовательности ДНК вблизи транскрибируемой последовательности
(а у эукариот также и от более далеких участков генома — энхансеров
и сайленсеров) и от наличия или отсутствия различных белковых
факторов.
Момент перехода РНК-полимеразы от инициации транскрипции к
элонгации точно не определен. Три основных биохимических события
характеризуют этот переход в случае РНК-полимеразы кишечной
палочки: отделение сигма-фактора, первая транслокация молекулы
фермента вдоль матрицы и сильная стабилизация транскрипционного
комплекса, который кроме РНК-полимеразы включает растущую цепь РНК
и транскрибируемую ДНК. Эти же явления характерны и для
РНК-полимераз эукариот. Переход от инициации к элонгации
сопровождается разрывом связей между ферментом, промотором,
факторами инициации транскрипции, а в ряде случаев — переходом
РНК-полимеразы в состояние компетентности в отношении элонгации
(например, фосфорилирование CTD-домена у РНК-полимеразы II). Фаза
элонгации заканчивается после освобождения растущего транскрипта и
диссоциации фермента от матрицы (терминация).
На стадии элонгации в ДНК расплетено примерно 18 пар нуклеотидов.
Примерно 12 нуклеотидов матричной нити ДНК образует гибридную
спираль с растущим концом цепи РНК. По мере движения РНК-полимеразы
по матрице впереди нее происходит расплетание, а позади —
восстановление двойной спирали ДНК. Одновременно освобождается
очередное звено растущей цепи РНК из комплекса с матрицей и
РНК-полимеразой. Эти перемещения должны сопровождаться
относительным вращением РНК-полимеразы и ДНК. Трудно себе
представить, как это может происходить в клетке, особенно при
транскрипции хроматина. Поэтому не исключено, что для
предотвращения такого вращения двигающуюся по ДНК РНК-полимеразу
сопровождают топоизомеразы.
Элонгация осуществляется с помощью основных элонгирующих факторов,
необходимых, чтобы процесс не останавливался преждевременно. В
последнее время появились данные, показывающие, что регуляторные
факторы также могут регулировать элонгацию. РНК-полимераза в
процессе элонгации делает паузы на определенных участках гена.
Особенно четко это видно при низких концентрациях субстратов. В
некоторых участках матрицы длительные задержки в продвижении
РНК-полимеразы, т. н. паузы, наблюдаются даже при оптимальных
концентрациях субстратов. Продолжительность этих пауз может
контролироваться факторами элонгации.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №27
Тема урока Синтез ДНК
Цель урока:развивать и углублять знания по темесинтез ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Репликация ДНК – процесс самоудвоения ДНК. Происходит в S – период интерфазы. Репликация всех двуцепочечных ДНК поликонсервативна, т.е. в дочерней молекуле одна цепь родительская, а другая построена вновь. Репликация начинается в особых точках молекулы ДНК – точках инициации синтеза или точках ori. У прокариот на единственной молекуле ДНК имеется одна точка ori. У эукариот на одной молекуле ДНК (число молекул ДНК = числу хромосом) множество точек ori, расположенных на расстоянии 20000 пар нуклеотидов др. от друга. Материнская молекула ДНК начинает расходиться на 2 цепи в точке ori с образованием вилки репликации на материнской цепи (ориентированной 3'–5'). Дочерняя цепь строится из свободных дезоксинуклеотидов ядра сразу в направлении 5'-3'. И это строительство совпадает с удвоением вилки репликации, эта дочерняя цепь называется лидирующей. На материнской цепи ДНК, антипараллельно матричной, дочерняя цепь запаздывающая, она строится отдельными кусками или фрагментами – указаки, т.к. направление строительства противоположно движению вилки репликации. Для начала синтеза ДНК требуется прайнер – короткая РНК – затравка длиной 5-10 рибонуклеотидов. Прайнер связывает первый свободный дезоксинуклеотид и начинает строить дочерние цепи ДНК. В лидирующей цепи прайнер один, а в запаздывающей у каждого отрезка указаки – длина этих отрезков 100-200 нуклеотидов у высших организмов, 1000-2000 у прокариот.
При
синтезе макромолекул ДНК, РНК или белков один активный центр
фермента не в состоянии обеспечить специфическую последовательность
четырёх кодирующих единиц. Он может связывать между собой только
один или несколько «строительных блоков», а нуклеиновые кислоты
содержат в своём составе тысячи нуклеотидов. Поэтому природа пошла
здесь по другому пути: матрицей для синтеза цепи молекулы ДНК
служит другая цепь ДНК.
Транскрипция ДНК в ходе деления клеток начинается с разделения двух
цепей, каждая из которых становится матрицей, синтезирующей
нуклеотидную последовательность новых цепей. Хеликаза,
топоизомераза и ДНК-связывающие белки расплетают ДНК, удерживают
матрицу в разведённом состоянии и вращают молекулу ДНК.
Правильность репликации обеспечивается точным соответствием
комплементарных пар оснований. Репликация катализуется несколькими
ДНК-полимеразами, а транскрипция – ферментом РНК-полимеразой. После
репликации дочерние спирали закручиваются обратно уже без затрат
энергии и каких-либо ферментов.
Сравнительно неплохо изучен процесс репликации и транскрипции ДНК
бактерий. Их ДНК способна реплицироваться, не распрямляясь в
линейную молекулу, то есть в кольцевой форме. Процесс, по-видимому,
начинается на определённом участке кольца и идёт сразу в двух
направлениях (в одном – непрерывно, во втором – фрагментарно с
последующим «склеиванием» фрагментов). Инициация репликации
находится под контролем клеточной регуляции. Скорость репликации
ДНК составляет около 45 000 нуклеотидов в минуту; таким образом,
родительская вилка расплетается со скоростью 4500 об/мин.
Ферменты репликации: для синтеза прайнеров нужна РНК – полимераза. для образования эфирных связей между фосфатами дезоксинуклеотидов при строительстве цепи ДНК нужна ДНК полимеразы. Для вырезания прайнеров, неправильно включённых в состав ДНК нуклеотидов, нужна ДНК – экзонуклеаза. Для сшивания фрагментов указаки в сплошную запаздывающую дочернюю цепь нужен фермент ДНГ – лигаза. Скорость синтеза ДНК у эукариот 10-100 пар нуклеотидов в секунду, а у прокариот 1500 пар (в одном месте). Репликация по типу катящегося колеса. Двухцепочечная кольцевая ДНК надрезается в точке начала катящегося кольца. Причём надрезается одна цепь из двух – матричная. К освободившемуся 3' концу этой цепи начинают пристраиваться свободные дезоксинуклеотиды. По мере удлинения дочерней цепи ДНК 5' конец из материнского кольца вытесняется. Когда 3' и 5' концы встретятся в одной точке, синтез ДНК прекращается и дочернее кольцо отделяется от материнского.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №28
Тема урока: Созревание РНК
Цель урока:развивать и углублять знания по темесозревание РНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Во многих генах высших организмов последовательности нуклеотидов, кодирующие аминокислоты, чередуются с некодирующими. Кодирующие последовательности называются экзонами, а некодирующие После переписывания наследственной информации из ДНК в РНК получается «сырой продукт» — молекула РНК, в которой также вперемежку расположены экзоны и интроны. Чтобы с такой РНК была считана правильная аминокислотная последовательность, из неё необходимо «вырезать» всё ненужное, т. е. интроны, а оставшиеся экзоны «склеить» друг с другом. Иными словами, РНК нуждается в дальнейшей обработке или, как говорят биохимики, созревании. Так и происходит на самом деле. В клетках высших организмов «сырая» РНК разрезается на более короткие кусочки, а потом некоторые из них склеиваются между собой.
В большинстве случаев в процессе разрезания-склеивания принимают участие целые молекулярные комплексы, состоящие из небольших молекул РНК и белков. Они играют роль ферментов, которые ускоряют и контролируют правильное протекание химических реакций, сопровождающих созревание матричной РНК. Но некоторые интроны вырезаются без всякой посторонней помощи. Учёные пришли к заключению, что в таких случаях интрон сам выступает в роли фермента, отвечающего за собственное удаление из РНК и склеивание двух обрамлявших его экзонов. Это совершенно потрясающее явление природы, поскольку ферментативную активность здесь проявляет не белок, а молекула РНК!
Помимо разрезания-склеивания молекулы РНК высших организмов претерпевают и другие химические изменения в ходе созревания. Только после такой обработки появляется «зрелая» матричная РНК, с которой может работать рибосома. По этой причине, в отличие от своих «коллег» в низших организмах, рибосомы эукариот не могут начать производство белков, пока не завершится переписывание из ДНК в РНК: они вынуждены ждать созревания матричной РНК.
Процесс формирования зрелых (то есть функционально активных)
молекул РНК из предшественников,
называемыйпроцессингом – важнейший этап
образования многих видов и-РНК. Все стабильные РНК бактерий
также синтезируются в виде первичных
транскриптов, из которых затем образуются
зрелые р-РНК или т-РНК. Аналогичным
путем происходит образование и
эукариотических р-РНК и т-РНК.
В отличие от эукариотических, большинство бактериальных и-РНК представляют собой первичные транскрипты, которые в состоянии непосредственно взаимодействовать с рибосомами, так что только в очень редких случаях их трансляции должен предшествовать процессинг.
У эукариот, напротив, образование зрелой и-РНК, кодируемойпрерывистым геном – наиболее сложный процесс из всех видов процессинга РНК, включающий большое число реакцийсплайсинга(вырезания), обеспечивающих соединениеэкзоновпутем удаления интронов.
Все реакции процессинга являются высокоспецифичными, что приводит к образованию зрелых молекул РНК с уникальными 5'- и 3'-концами. Реакции процессинга осуществляютсяспецифическими ферментами (рибонуклеазами), способными расщеплять фосфодиэфирные в молекулах РНК.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №29
Тема урока: Распад мРНК
|
Цель урока:развивать и углублять знания по темераспад мРНК Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся. Ход урока. Организационный момент: проверка готовности учащихся к уроку Новая тема: |
Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. Различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие деполимеризациюнуклеиновых кислот с образованием олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или олигонуклеотидов. Помимо гидролитическихнуклеаз, имеются ферменты, катализирующие распад нуклеиновых кислот, например, посредством трансферазной реакции. Они катализируют перенос остатка фосфорной кислоты от 5'-го углеродного атомарибозы одного мононуклеотида ко 2'-му углеродному атому соседнего мононуклеотида, сопровождающийся разрывом межнуклеотидной связи и образованием фосфодиэфирной связи между 2'-м и 3'-м углероднымиатомами рибозы одного и того же мононуклеотида. К настоящему времени открыты группы нуклеаз, катализирующие распад ДНК и РНК.
Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфир-ных связей в одной из двух цепеймолекулы ДНК между 3'-м углеродным атомом дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов:
ДНК + (n–1) Н2O –> n-Олигодезоксирибонуклеотиды.
Среди продуктов реакции открыты также моно- и динуклеотиды. Типичными представителями этихферментов являются ДНКазы поджелудочной железы. Одна из них (ДНКаза I) была получена в чистом виде, расшифрована последовательность всех ее 257 аминокислотных остатков. Фермент наиболее активен при рН 6,8–8,0, активируется двухвалентными ионами Mg2+и Мn2+ и ингибируется конечными продуктами ферментативной реакции – олигонуклеотидами.
Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Представителем их является ДНКаза II, выделенная из селезенки, имеющая мол. массу 38000 и состоящая из 343 аминокислотных остатков. В составе этой ДНКазы открыт глюкозамин. Фермент также активируетсяионами металлов, ингибируется анионами; его оптимум рН между 5,5 и 5,8.
Помимо этих ферментов, открыты (преимущественно у микроорганизмов) еще экзодезоксирибонуклеазы, гидролизующие фосфодиэфирные связи молекулы ДНК с отщеплением концевых 5'-дезоксирибонуклеотидов. Например, из E. coli выделено четыре таких фермента, обозначаемых экзодезоксирибонуклеазами I, II, III и IV.
Рестриктазы – ферменты ДНКазного типа действия – катализируют распад чужеродной (в основном фаговой)ДНК в строго определенных участках молекулы, имеющих структуру палиндромов. Из E. coli выделены и охарактеризованы две такие рестриктазы, обозначаемые EcoRI и EcoRII соответственно. Рестриктазыоказывают строго специфическое действие, поэтому они используются для расшифровки последовательности нуклео-тидных остатков в ДНК фагов и вирусов. Кроме того, это уникальное свойстворестриктаз находит все большее практическое применение в генетической инженерии при «вырезании» определенных фрагментов ДНК и «встраивании» их в геном бактериальной ДНК (получение рекомби-нантных ДНК). В результате клетке передается ряд не свойственных ей прежде наследственных признаков. Теоретическое и главным образом практическое значение подобных исследований трудно переоценить. Свидетельством огромного интереса к проблемам генетической инженерии является создание и успешное выполнение в институтах Российской АН и лабораторий ряда стран совместной комплексной программы – проекта «Рестриктазы».
Многие сотни рестриктаз выделены в очищенном состоянии и уже являются коммерческими препаратами.Из ферментов, катализирующих гидролитический распад РНК, наиболее изучены рибонуклеазы I. Они гидролизуют фосфодиэфирные связи внутри молекулы РНК. Выделенная из поджелудочной железы многих животных РНКаза состоит из 124 аминокислотных остатков во всех случаях, хотя ферменты несколько различаются последовательностью аминокислотных остатков; выяснена также третичная структура рядаРНКаз (см. главу 4). Получен в гомогенном состоянии из плесневого гриба рода Aspergillus ферментгуанилрибонуклеаза, катализирующая эндонуклеолитическое расщепление РНК.
Из ферментов, осуществляющих распад ДНК и РНК не по гидролитическому пути, следует назвать полинуклеотид-фосфорилазу и группу ДНК-гликозидаз. В настоящее время подробно изучены физико-химические свойства и биологическая роль микробной полинуклеотид-фосфорилазы в лаборатории С.С. Дебова; в той же лаборатории фермент открыт в животных тканях.
Механизм действия фермента сводится к переносу нуклеотидных остатков с РНК на неорганический фосфат, при этом образуется рибо-нуклеотиддифосфат (РДФ):
![]()
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №30
Тема урока: Трансляция мРНК у эукариот
Цель урока: развивать и углублять знания по теметрансляция мРНК у эукариот.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Процесс трансляции эукариотической мРНК в основном аналогичен таковому прокариотической мРНК. За некоторыми отмеченными выше исключениями, генетический код универсален и кодоны последовательно транслируются с помощью специфических аминоацил-тРНК-синтетаз на рибосомах. Есть, однако, и три явных различия, обусловленных определенными свойствами эукариотических клеток. Во-первых, аппараты транскрипции и трансляции у эукариот физически разобщены, поскольку транскрипция осуществляется в ядре, а трансляция – в цитоплазме. Во-вторых, на 5'- и 3'-концах эукариотических мРНК имеются особые структуры. И в-третьих, эукариотические мРНК, за исключением мРНК, транскрибируемых с ДНК геномов вирусов, обычно содержат только одну белок-кодирующую последовательность.
Структура и свойства участников трансляции эукариотической мРНК пока изучены гораздо хуже, чем у прокариот. И хотя у эукариот выделяют те же три стадии процесса – инициацию, элонгацию и терминацию, – на каждой из них требуется больше нерибосомных белковых факторов. Несмотря на эти различия, последовательности, кодирующие белки прокариот, нормально транслируются эукариотическими системами трансляции при условии соответствующей модификации их мРНК на 3'- и 5'-концах. И наоборот, кодирующие последовательности эукариот эффективно транслируются системами прокариот, если у них перед 5'-концом инициаторного кодона AUG имеется последовательность Шайна-Дальгарно. Это значит, что трансляционные аппараты обоих типов организмов могут осуществлять свои функции, несмотря на особенности нуклеотидных последовательностей мРНК из разных источников.
а. Особые модификации мРНК эукариот
У эукариотических мРНК, транскрибированных с ядерных или вирусных геномов РНК-полимеразой II, всегда модифицированы 5'-концы, которые в этом случае называют «кэпами». РНК, транскрибируемые эукариотическими РНК-полимеразами I и III, не кэпированы и имеют обычные 5'-фосфатные концы. У большинства мРНК, синтезируемых РНК-содержащими вирусами животных, также имеются кэпы, хотя они синтезируются вирусными РНК-транскриптазами. Многие некэпированные мРНК неэффективно транслируются эукариотическими белоксинтезирующими системами из-за слабого связывания рибосом с мРНК. Кэпирование происходит на 5'-нуклеозидтрифосфате вскоре после инициации синтеза РНК-транскриптов и задолго до его завершения.
На 3'-концах эукариотических мРНК имеются еще и полиаденилатные последовательности. Такой 3' – «хвост» из 50–200 аденилатных остатков не кодируется смысловыми последовательностями соответствующих генов, а присоединяется посттранскрипционно, после разрезания транскрипта в специфическом месте за сигналом терминации трансляции.
б. Инициация трансляции на 5'-кэпированных концах малыми рибосомными субчастицами
Как мы уже говорили, обязательным этапом при инициации трансляции прокариотической мРНК является диссоциация 70S-рибосомы; точно так же и 80S-рибосомы должны диссоциировать до начала трансляции эукариотических мРНК. Малая субчастица в комплексе со множеством белков-помощников, из которых один или несколько нужны для диссоциации рибосомы на составляющие субчастицы, связывает особую инициаторную met-тPHK. И вновь для связывания инициаторной аминоацил-тРНК необходимы GTP и особый белок – eIF-2. У эукариот, однако, met-TPHK не подвергается N-формилированию; но, как и у прокариот, структура тРНК отличается от структуры тPHKMMet. Комплекс 40S, содержащий met-тPHKIMet, GTP и целую армию других факторов eIF, связывается с мРНК вблизи кэпированного 5'-конца или прямо с этим концом; по крайней мере один из этих факторов узнает кэп и связывается с ним. Малая субчастица перемещается при помощи неизвестного пока механизма от кэпированного конца до первого кодона AUG. Никакой последовательности вблизи кодона AUG, аналогичной последовательности Шайна-Дальгарно, пока не обнаружено. Однако эффективность работы AUG в качестве инициатор-ного кодона зависит от наличия определенных фланкирующих нуклеотидов. Такой преинициаторный комплекс объединяется с 60S-субчастицей в ходе энерго- и фактор-зависимой реакции с образованием функционального комплекса инициации. Инициация белкового синтеза может регулироваться фосфорилированием и дефосфорилированием eIF-2.
в. Элонгация и терминация полипептидной цепи
Поэтапная трансляция последовательных кодонов с помощью аминоацил-тРНК у эу- и прокариот в принципе сходна. GTP и фактор элонгации eEF-1, соответствующий прокариотическому комплексу EF-Tu и EF-Ts, периодически поставляют рибосомам аминоацил-тРНК. GTP и eEF-2, являющиеся функциональными аналогами прокариотического EF-G, осуществляют транслокацию. Терминация трансляции у эукариот также происходит в одном из трех стоп-кодонов и сопровождается отделением свободных полипептидных цепей, мРНК и, возможно, 80S-рибосом от мРНК. По-видимому, всю серию терминационных событий осуществляют один фактор eRF и GTP.
В результате последовательных актов инициации образуются полисомы и одновременно, как и у прокариот, начинается трансляция множества кодирующих белки последовательностей. Заметное отличие трансляции у эукариот состоит в том, что клеточные мРНК обычно содержат одну-единственную кодирующую последовательность. Если в мРНК имеется несколько таких областей, то последующие либо вовсе не транслируются, либо транслируются неэффективно
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №31
Трансляция мРНК у прокариот
Цель урока:развивать и углублять знания по теметрансляция мРНК у прокариот.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Зная всех участников процесса, мы можем теперь приступить к рассмотрению химических реакций, протекающих при синтезе полипептидов, т.е. реакций, участвующих в собственно трансляции. Несмотря на то, что этот процесс протекает непрерывно от старта к финишу, обычно выделяют три его этапа: инициацию, элонгацию и терминацию. Рассматривая каждый из этапов направляемого мРНК синтеза полипептидной цепи, мы должны учитывать два основных свойства этого процесса. Вопервых, полипептидные цепи синтезируются однонаправленно: с аминоконца к карбоксиконцу. При этом карбоксильная группа уже образовавшегося участка полипептидной цепи соединяется с аминогруппой следующей присоединяемой аминокислоты с помощью пептидной связи. Это может произойти, лишь если карбоксильный конец растущей полипептидной цепи находится в активированном состоянии. Как мы уже отмечали, необходимая для этого энергия поступает в результате присоединения карбоксильной группы растущей полипептидной цепи и каждой присоединяемой аминокислоты к тРНК. Во-вторых, считывание мРНК начинается с кодона AUG, который обозначает 5'-конец кодирующей последовательности и детерминирует N-концевую аминокислоту синтезируемого полипептида. При инициации первая и вторая молекулы аминоацил-тРНК спариваются с первыми двумя кодонами мРНК. Далее трансляция продолжается в направлении 5'–>3' кодон за кодоном до тех пор, пока не достигнет стоп-сигнала, расположенного сразу же за кодоном, детерминирующим С-концевую аминокислоту.
а. Условия инициации
70S-рибосома способна осуществлять трансляцию последовательности мРНК, но не может инициировать этот процесс. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы. 30S-субчастица в комплексе с IF-1 и IF-3 связывает IF-2, GTP и Fmet-тРНК. Такой полный комплекс связывается с 5'-концом кодирующей последовательности мРНК вблизи кодона AUG. Очевидно, IF-2 способен отличить Fmet-тРНК от тРНК, и эта специфичность отчасти обеспечивается N-формильной группой, отсутствующей у ТРНК Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S^6-частицы с преинициаторным комплексом. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Как узнается первый кодон? Связывание 30S-6-частицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно за 10 нуклеотидов до 5'-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами последовательности из пяти-восьми нуклеотидов, называемой последовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3'-конца 16S-pPHK. Эффективность инициации существенно зависит от степени комплементарности между последовательностями Шайна-Дальгарно и 16S-pPHK и от расстояния пурин-богатого участка до кодона AUG. Эта особенность наряду с другими, о которых будет сказано позднее, и объясняет различия в эффективности трансляции различных мРНК.
Процесс инициации зависит также от вторичной структуры того участка молекулы мРНК, в котором находится инициаторный кодон AUG. Если этот кодон окажется внутри двухцепочечного участка, то инициация будет неэффективна или вовсе блокируется. Именно таким образом может регулироваться доступность инициаторного AUG-кодона для 30S-рибосомы. AUG становится недоступным, если он оказывается спаренным при образовании конденсированной формы зрелой мРНК, и, напротив, доступным для инициации во время транскрипции мРНК или во время трансляции других кодирующих последовательностей на той же молекуле мРНК.
б. Элонгация полипептидной цепи
При ассоциации двух рибосомных субчастиц перед инициацией трансляции образуются два функциональных участка, необходимых для сборки белка: Р- и А-участки. Fmet-TPHKj» занимает Р-участок, а для образования первой пептидной связи необходимо, чтобы аминоацил-тРНК, соответствующая следующему кодону, заняла А-участок. Для этого аминоацил-тРНК должна сначала связать EF-Tu и GTP. Образовавшийся тройной комплекс и доставляет аминоацил-тРНК к А-участку. GTP в это время гидролизуется, и комплекс отделяется от рибосомы. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК, а в Р – свободная тРНК.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться. Однако, прежде чем это произойдет, тРНК должна освободить Р-участок, образовавшаяся дипептидил-тРНК должна переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы осуществляются с помощью EF-G при GTP-зависимой транслокации рибосомы. Источником энергии для перемещения рибосомы к следующему триплету кодирующей последовательности и удаления свободной тРНК из Р-сайта служит реакция гидролиза GTP до GDP. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №32
Тема урока: Фолдинг белка
Цель урока:развивать и углублять знания по темефолдинг белка.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
Переход первичной структуры полипептида (слева) в третичную структуру (справа).
Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность,гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура — конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостикимежду пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами. Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков (более подробно это описано в статье Прионы).
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его аминокислотной последовательности.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №33
Цель урока:развивать и углублять знания по темемодификация белка.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Модификацибелковэто(от позднелат. Modificatioизменение) биогенная, происходит послезавершения трансляции матричной рибонуклеиновой кислоты, или мРНК,(синтез белка на мРНКматрице) илидо ее завершения. В пер-вом случае Модификация белков называется п о с т т р а н с л я ц и о н н о й, во втором -к o т р а н c л я ц ио н н о й. Осуществляется благодаря р-циям разл. функц. групп аминокислотных остатков, а также пептидныхсвязей и обусловливает конечную форму белковой молекулы, ее физиол. активность, стабильность,перемещения внутри клетки.
Внеклеточные (секретируемые) белки, а также мн. белки цитоплазматич. мембраны и разл. Внутри-клеточныхкомпартментов (обособленных участков клетки) подвергаются гликозилированию, в результате которогообразуются гликопротеины. Наиболее сложно организованы маннозосодержащие цепи, присоединенные кполипептидам Nгликозидной связью. Начальная стадия формирования таких цепей протекаеткотрансляционно по схеме:
Dol-долихол (полипренол), DolЧРЧР-долихолпирофосфат, Glc-глюкоза, GlсNАс-N-ацетил-D-глюкозамин, Маn-манноза
Последующии стадии осуществляются посттрансляционно с участием неск. ферментов, локализованных в разныхсубклеточных компартментах. Так, для G-белка вируса везикулярного стоматита, гликозидные цепи к-рогопостроены из 15 углеводных остатков, установлена такая последовательность событий. Сначала вэндоплазматической ретикулуме происходит в две стадии отделение терминальных остатков глюкозы с участиемдвух разных глюкозидаз. Затем маннозидазы (I и II) удаляют 6 ос-татков маннозы, а N-ацетил-Dглюкозаминтрансфераза осуществляет присоединение трех остатков GlcNAc к остаткам маннозыгликопротеина. Наконец, в комплексе Гольджи с этими остатками связываются с участием соответствующихтрансфераз остатки фукозы, галактозы и сиаловой к-ты. Моносахаридные остатки могут подвергатьсяфосфорилированию, сульфированию и др. модификациям.
Гликозилированию секретируемых белков предшествует протеолитич. процессинг отделение от N-концаполи
пептидной цепи "сигнальной" последовательности аминокислот. В эукариотич. клетках (клетки всехорганизмов, за исключением бактерий и синезеленых водорослей) этот процесс осуществляетсяконтрансляционно, в прокариотических клетках (клетки бактерий и синезеленых водорослей) он может протекатьпосттрансляционно. Наиболее распространенные сигнальные последовательности включают 23 аминокислотных остатка. Характерные особенности этих последовательностей наличие на конце короткого положительнозаряженного участка, за которым следует гидрофобный участок, содержащий от 7 до 14 аминокислотныхостатков. Сигнальные последовательности завершаются консервативным по длине (5-7 остатков)гидрофильным участком, на конце которого чаще всего находятся остатки аланина, глицина, серина,треонина, цистeина или глутамина.
Почти все функцион. классы внеклеточных белков (ферменты, гормоны, иммуноглобулины и др.) содержатдисульфидные связи. Они образуются из групп SH цистенна в ходе многостадийного процесса с участиемфермента дисульфидизомеразы. На его ранних стадиях появляется значит. количество "неправильных"дисульфидных мостиков, которые ликвидируются в результате тиолдисульфидного обмена, в котором, повидимому, участвует цистамин (H2NCH2CH2S)2. Предполагают, что такой "перебор" связей происходит до техпор, пока не возникает наиб. стабильная третичная структура, в ко-торой дисульфидные мостики "захоронены" ивследствие этого недоступны реагентам.
К наиболее распространенным модификациям внутриклеточных белков относятся фосфорилированис идефосфорилирование по группе ОН остатков серина, тирозина и треонина, которые осуществляются с участием ферментов протеинкиназ и фосфатаз по схеме:

АТФ - аденозинтрифосфат, АДФ - аденозиндифосфат, Р -фосфорная к-та или ее остаток
Фосфорилирование сопровождается активацией или инактивацией ферментов, напр. гликозилтрансфераз, атакже изменением физ.-хим. св-в неферментных белков. Обратимое фосфорилирование белков контролирует, например, такие важные процессы, как транскрипция и трансляция, метаболизм липидов,глюконеогенез, мышечное сокращение.
Белки митохондрий и хлоропластов, кодируемые ядерными ДНК, имеют на N-конце избыточныеаминокислотные последовательности, которые избирательно направляют полипептидные цепи в определенныекомпартменты органелл, после чего отщепляются в результате протеолиза с участием специфич.эндопептидаз. Избыточные последовательности предшественников митохондриальных белков существенноразличаются по количеству аминокислотных остатков; их может быть от 22 до 80. Короткие последовательностихарактеризуются высоким (20-25%) содержанием положительно заряженных аминокислотных остатков,равномерно расположенных по полипептидной цепи. Длинные последовательности включают дополнительноучасток, сос-тоящий из гидрофобных аминокислот
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №34
Тема урока: Получение антибиотиков.
Цель урока:развивать и углублять знания по темеполучение антибиотиков.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Способностью вырабатывать антибиотики обладают не все микроорганизмы, а лишь некоторые штаммы отдельных видов. Так пенициллин образуют некоторые штаммы Penicillium notatum и P. chrysogenum, астрептомицин определенный штамм Streptomyces griseus, тогда как другие штаммы тех же видов
либо вообще не вырабатывают антибиотики, либо вырабатывают, но другие. Существуют также различия междуштаммамипродуцентами антибиотиков, причем эти различия могут быть количественными иликачественными. Один штамм, например, дает максимальный выход данного антибиотика, когда культурарастет на поверхности среды и находится в стационарных условиях, а другой - лишь когда его культурапогружена в среду и постоянно встряхивается. Некоторые микроорганизмы выделяют не один, а несколькоантибиотиков. Так, Pseudomonas aeruginosa образует пиоцианазу, пиоцианин, пиолипоевую кислоту и другиепиоцианиновые
соединения; Bacillus brevis производит грамицидин и тироцидин (смесь, известную под названиемтиротрицин); P. notatum - пенициллин и пенатин; Aspergillus flavus - пенициллин и аспергилловую кислоту;Aspergillus fumigatus - фумигатин, спинулозин, фумигацин (гельволевую кислоту) и глиотоксин; Streptomycesgriseus - стрептомицин, маннозидострептомицин, циклогексимид и стрептоцин; Streptomyces rimosus -окситетрациклин и римоцидин; Streptomyces aureofaciens - хлортетрациклин и тетрациклин. Один и тот жеантибиотик может продуцироваться микроорганизмами разного рода. Так, глиотоксин образуют видыGliocladium и Trichoderma, а также Aspergillus fumigatus и др. Разные микрорганизмы или их штаммы могутвырабатывать разные химические формы одного и того же антибиотика, например разные пенициллины илиразличные формы стрептомицина. В последние годы выделено и описано огромное число антибиотиков,продуцируемых различными организмами. Способностью вырабатывать антибиотики обладают какспорообразующие, так и не образующие спор бактерии, а кроме того, более половины изученных на этотпредмет родов грибов.
Неспорообразующие бактерии. Из группы бактерий, ранее называемых Bacillus pyocyaneus, а позднееизвестных как Pseudomonas aeruginosa, выделены пиоцианин и пиоцианаза. Другие не образующие спорбактерии тоже вырабатывают антибиотики, сильно различающиеся по химической структуре иантибактериальным свойствам. Примером могут служить колицины, производимые различными штаммамикишечной палочки (Escherichia coli).
Спорообразующие бактерии. Многие виды спорообразующих бактерий вырабатывают различныеантибиотики. Так, штаммы Bacillus subtilis производят бацитрацин, субтилин и др.; B. brevis - тиротрицин, B.polimixa (B. aerosporus) - полимиксин (аэроспорин). Из B. mycoides, B. mesentericus и B. simplex выделеныразнообразные, еще недостаточно изученные соединения: бациллин, колистатин и др. Многие из нихпрепятствуют росту грибков.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
ЖАМБЫЛ ОБЛЫСЫ Т.РЫСҚҰЛОВ АУДАНЫ ӘКІМДІГІНІҢ БІЛІМ БӨЛІМІНІҢ
«АҚТОҒАН ОРТА МЕКТЕБІ» КОММУНАЛДЫҚ МЕМЛЕКЕТТІК МЕКЕМЕСІ
.
«Основы молекулярной биологии»
Рабочая тетрадь
11 класс
Учитель биологии Ахимбекова Айман Несипбаевна
Когершин 2016 год
Урок №1
Тема: Компоненты ядра
Заполни таблицу.
Назови органеллы клетки
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
6 |
|
|
7 |
|
|
8 |
|
|
9 |
|
|
10 |
|
|
11 |
|
|
12 |
|
|
13 |
|
|
14 |
|
|
15 |
|
Урок № 2
Тема: Ядерная оболочка
Дополните предложения
-
В чём заключается функции плазматической мембраны……………………………………………………………………………………………………………………………………………………………………………………………….
-
Как взаимосвязано ее строение с функциями в клетке………………………………………………………………………………………………………………………………………………………………………………………………………
-
Какова роль цитоплазмы в клетке………………………………………………………………………………………………………………………………………………………………………………………………………
-
Заполните таблицу
|
Название компонентов и органоидов клетки |
Строение |
Функции |
|
|
|
|
Урок № 3
Тема урока: Эволюционное значение ядра
Дополните предложения
-
Какие вещества называются органическим? Какие биополимеры вы знаете?.............................................................................................................................................................................................................................................................................................................................................................................................................................................................................
-
Вставьте пропущенное: Молекула полимера состоит ………………………………………………………………………………………………………
………………………………………………………………………………………………………
К мономера углеводов относятся…………………………………………………………………
………………………………… Их молекулы состоят из………………….……………атомов.
-
Заполните таблицу
-
Название
Местонахождение в клетке и в организме
Выполняемые функции
-
Моносахариды
-
Полисахариды
-
Урок № 4
Тема урока: Происхождение ядра
-
Основное функциональное отличие клеток эукариот от клеток прокариот заключается в………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Задача. В результате энергетического обмена в клетке образовалось 5 моль молочной
кислоты и 27 моль углекислого газа.
Определите:
а) сколько всего моль глюкозы израсходовано?
б) сколько из них подверглось полному расщеплению, а сколько гликолизу?
в) сколько энергии запасено?
г) Сколько моль кислорода пошло на окисление?
Урок № 5
Тема урока: Молекулярный механизм.
Дополните предложения
-
Опишите особенности репликации ………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Допишите предложение: Белковая молекула относится к сложным………………… Роль мономеров белка выполняют…………………… ………………………….., в состав молекулы которых входят атомы………………………………………….. .
3. Даны два звена молекул биополимеров: 1) А-Б-К-С-И-В-А-П;
2) Г-Г-Г-Г-Г-Г-Г. Какое из этих звеньев – углевод а какое – белковая молекула?
Ответ поясните.
4.Белки подразделяются на……………………………… , простые белки называются ……………………. , сложные …………………………… . К простым белкам относятся ……………………………., к сложным белкам относятся……………………………. .
Урок № 6
Тема урока: Репликация основной части ДНК
Дополните предложения
-
Репликация ДНК — ключевое событие в ходе ………………………………Принципиально, чтобы к моменту …………………. ДНК была реплицирована полностью и при этом только один раз. Это обеспечивается определёнными механизмами ……………………….. ………………………. ДНК.
-
Репликация проходит в три этапа:
-
……………………………………….
-
……………………………………….
-
……………………………………….
3.Опишите функции репликации ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 7
Тема урока: Репликация теломерных отделов
Дополните предложения
-
В клеточном геноме обратные транскриптазы ……………………… в ретротранспозонах.
- РНК, используемая ……………………………….. для синтеза …………………………. ДНК в качестве матрицы, входит в состав этого ……………………. . В этом уникальность ………………… на сегодня это единственая известная …………………………… обратная транскриптаза
-
Теломераза – это……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 8
Тема урока: Механизм действия теломеразы
Дополните предложения
-
Реплика́ция — процесс ………………………………………………………… дочерней молекулы…………………………………………………………… на матрице родительской молекулы ДНК. В ходе последующего деления …………………………………. ………………………………….. каждая дочерняя клетка получает по …………………………. копии молекулы ДНК, которая является …………………………….. ДНК исходной ………………….клетки.
-
Каждая молекула ДНК состоит из …………….цепи исходной родительской молекулы и одной вновь ……………………………. цепи. Такой механизм …………………….. называется полуконсервативным.
Урок № 9
Тема урока: Механизмы действия теломер в соматических клетках
Дополните предложения
-
Существует некоторая ………………………….. длина теломеры, когда ……………… еще разрешено. Иными словами, ………………………. ………………………. наступает до того, как начал разрушаться ……………………….текст генома.
-
Старение особи - это нормальная ……………………… функция, способствующая прогрессивной ………………………. вида, размножающегося ……………………… путем.
Урок № 10
Тема урока: Теломераза, рак и старение
-
Высокая ……………………………….. активность наблюдается в ………………………. клетках ………………………….. в течение всей его жизни.
-
Соответственно их теломеры состоят из ……………………… числа ДНК-повторов и содержат все ……………………………….. …………………….. для нормальной пролиферации клеток.
Урок № 11
Тема урока: Метилирование ДНК
Ответьте на вопросы
-
Что такое нуклеоотид?.....................................................................................................................................................................................................................................................................................................
-
Ондоспиральные и двусприальные нуклеотиды…………………………………………………………………………………………………………………………………………………………………………………………………
-
Какими соединения связываются между собой нуклеотиды ………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Как связывается между собой двусприальнаяДНК?.....................................................................................................................................................................................................................................................................................................................................................................................................................................................
Заполните таблицу
|
Нуклейновые кислоты |
Строние молекулы |
Располежение в клетку |
Роль в клетке |
|
|
|
|
|
Урок № 12
Тема урока: Метилирование ДНК у человека
Дополните предложения
-
Метилирование ДНК — это …………………….. ………………………… ДНК без изменения самой …………………………………………. ……………………………………..ДНК, что можно рассматривать как часть …………………… …….. составляющей генома.
-
Опираясь на комплементарность нуклеотидов составьте вторую цепь ДНК
ГЦ АТ
ГА АТ
ЦГ ЦА
АА АЦ
Урок № 13
Тема урока: Роль метилирование в онкогенезе
Дополните предложения
-
Сопоставление данных по …………………. людей, предрасположенных к онкологическим…………………………………………….., с профилем …………………………….. их ДНК позволило предположить, что примерно в 20% случаев …….................................. ………………………………….обнаруживается взаимосвязь между уровнем ……………………………….. определенных ………………….. и полиморфизмами генов, связанных с ……………………….заболевания раком.
-
Задача. Дана молекула ДНК с относительной молекулярной массой 69000, из них 8625 приходится на долю адениловых нуклеотидов. Найдите количество всех нуклеотидов в этой ДНК. Определите длину этого фрагмента.
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Урок № 14
Тема урока: Репликация повреждения ДНК
-
Задача. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 18%. Определите процентное содержание других нуклеотидов в этой ДНК.
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
-
Задача. В молекуле ДНК обнаружено 880 гуаниновых
нуклеотидов, которые составляют 22% от общего числа нуклеотидов в этой ДНК.
Определите: а) сколько других нуклеотидов в этой ДНК? б) какова длина этого фрагмента?
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 15
Тема урока: Повреждение оснований
Дополните предложения:
-
Если разрывы в каждой из ……………………. расположены рядом, то
это может привести к……………………………………………… хромосомы. Пути снижения дестабилизирующего эффекта алкилирующих соединений на ………………………………….. включают………………………………, обмен сестринскими…………………………………...., разрушение или ………………………………………………. хромосом.
-
Эти атомы кислорода обычно находятся в …………………………………………
для правильного ………………………….оснований. Однако этилирование …………………….. …….. эти атомы в…………………………………… ………………………………, таким образом, дестабилизируя обычное углеродное ………………………… между основаниями в противоположных цепях, что часто приводит к возникновению ……………………….. мутации.
Урок № 16
Тема урока: Преждевременная терминация белковой цепи
Дополните предложения
-
В первом случае можно пересадить …………………. Из…………….. ……………. кишечного ……………………………… головастика в ……………………. с убитым с помощью ……………………………………. облучения ядром. Из такой синтезированной клетки ……………………………………. нормальная лягушка.
-
Во втором случае клетки передней части…………………………. дрозофилы способны …………………………… только структуры……………………. части тела имаго, а клетки задней части бластодермы только ……………………. задней части тела
Урок № 17
Тема урока: Строение и функции хромасом
Дополните предложения:
-
Хромосомы выполняют функцию …………………………………………………… ………………………………………….аппарата клетки. В них в линейном порядке……………………………………….. …………………………………, каждый из которых занимает строго определенное место (локус) в……………………………………….. В каждой хромосоме…………………………………. ……………………, но для нормального развития организма необходим ………………………………… …………………………….полного хромосомного набора
Задача. На фрагменте одной нити ДНК нуклеотиды расположены в последовательности:
А-А-Г-Т-Ц-Т-А-Ц-Г-Т-А-Т.
Определите процентное содержание всех нуклеотидов в этом гене и его длину.
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 18
Тема урока: Организация генетического материала способ записи
Дополните предложения:
-
В состав каждого мономера ДНК входит углевод пентоза ………………………………………………….. напротив азотистого основания аденина находится …………………………. тимин через …………………………………. связь дополняет аденин находится………………. …………………………. связь дополняет собой………………………..
2. Мономеры ДНК соединаются между собой через углевод и остаток фосфорной кислоты Это называется …………………………………… эти две ……………………………. ..соединяются между собой.
По сравнению с другими нуклеотидами …………………………………. в молекула ДНК составляет 30% определите количество других нуклеотидов
Урок № 19
Тема урока: Способ записи генетической информации в молекуле ДНК. Биологический код и его свойства.
Дополните предложения:
-
Небольшая часть молекулы ДНК состоит из следующей цепи: ЦАА – АЦА – ААА достройте вторую цепь ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
-
Порядок расположения нуклеотидов на участке цепи такое А-И-Т-Ц-Т-Г-А-Ц-Т-Г- Определите соответствующую ей вторую цепь ДНК ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………...
-
В процессеудвоении ДНК образующий молекулы. В какой из новых молекул сохранены принцип комплементарности?....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Урок № 20
Тема урока: Оперонная организация генетического материала у бактерий.
Дополните предложения:
-
При определенных условиях с ………………………………….. ………………………….. специфический белок-репрессор, и это ……………………………………….. «прочтение» РНК-полимеразой ………………………………….. группы генов. У эукариот регуляцию «прочтения» ……………………………………….. осуществляют не только белки-репрессоры, но и белки-активаторы — ……………………………………………… факторы
-
Эти факторы имеются во всех ………………………………..и необходимы для «прочтения» любого ………………………………………… гена. Другие транскрипционные факторы ……………………………………….активность только …………………………………генов, и локусы ДНК, …………………………………. … такие факторы, называются энхансерами.
Урок № 21
Тема урока: Конститутивные гены и белки
Дополните предложения:
-
В триптофановом опероне, как и…………………………, тоже имеется двойной механизм регуляции. Во-первых, как обычно, …………………………………. ……………………………. РНК-полимеразы по оператору.
-
В процессе …………………………………………….этого отдела образуется лидерный участок мРНК. Последний тут же …………………………………….. ………………………….. и начинает …………………………………с образованием лидерного пептида (ЛП).
Урок № 22
Тема урока: Количественные особенности генома эукариот
Дополните предложения:
-
Низкочастотные повторы …………………………….., повторяющиеся десятки раз.
Промежуточные, или…………………………, повторы последовательности, ……………… сотни и тысячи раз.
-
Таким образом, в случае высокочастотных …………………………………. ДНК обнаруживается тождество молекулярной организации и ………………….. свойств ………………………… ДНК эукариот
Урок № 23
Тема урока: Конститутивные гены и белки.
Дополните предложения
-
Дополнително предложения: Разрушение природой структуры белка называют …………… Белок ускоряющий реакцию биоцинтез называется ………………. Газы транспоттируются белком ………………………….. Белок – источник…………….. Белок защищающий от чужеродных тел называются………………………..
2.Решите задачу.
Задача №1. Гемоглобин крови человека содержит 0, 34% железа. Вычислите минимальную молекулярную массу гемоглобина.
Решение:………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Задача№2 Альбумин сыворотки крови человека имеет молекулярную массу 68400. Определите количество аминокислотных остатков в молекуле этого белка.
Решение:…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Урок №24
Тема урока: Особенности репликации эукариотических хромосом
Дополните предложения
-
У многоклеточных эукариот в ходе ………………………………… из исходной клетки развивается ………………………… организм. На разных этапах ……………………….. в разных ………………………..с разной …………………………….. экспрессируются разные гены.
-
Заполни таблицу
Сравните сходство и различия клеток эукариот
|
Строение
|
Эукариотическая клетка |
Прокариотическая клетка |
|
|
|
|
Урок № 25
Тема урока: Структура РНК
Дополните предложения
-
Углевод входящий в состав
-
РНК…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
При денатурации белок? ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Мономер РНК, по которому отличается от ДНК……………………....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
-
Задача Вирусом табачной мозаики (РНК — овый вирус) синтезируется участок белка с аминокислотной последовательностью: Ала – Тре – Сер – Глу – Мет-
Под действием азотистой кислоты (мутагенный фактор) цитозин в результате дезаминирования превращается в урацил. Какое строение будет иметь участок белка вируса табачной мозаики, если все цитидиловые нуклеотиды подвергнутся указанному химическому превращению?
Решение:…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Урок №26
Тема урока: Синтез РНК.
Задача В процессе энергетического обмена произошло расщепление 7 моль глюкозы, из которых полному подверглось только 2.Определите:………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
а) сколько моль молочной кислоты и СО2 при этом образовалось?...........................................................................................................................................................................................................................................................................................................................
б) сколько АТФ при этом синтезировано?.........................................................................................................................................................................................................................................................................................................................
в) сколько энергии запасено в этих молекулах АТФ?..........................................................…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок №27
Тема урока Синтез ДНК
-
Задача Последовательность нуклеотидов в начале гена, хранящего информацию о белке инсулине, начинается так:
АААЦАЦЦТГЦТТГТАГАЦ
Напишите последовательности аминокислот, которой начинается цепь инсулина
Решение: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Задача Что тяжелее: белок или его ген?
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………
Урок №28
Тема урока: Созревание РНК
1. Задача Белок содержит 0,5% глицина. Чему равна минимальная молекулярная масса этого белка, если Мглицина = 75,1? Сколько аминокислотных остатков в этом белке?
Решение: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
2.Допишите предложения: Кодон состоит из четырёх …………………………… Они, объединялись по двое, образуют соответствие ……………………………………………РНК образуется в процессе ………………… …………………………… В процессе……………… происходит синтез………………………… .
-
В чем заключает роль кодон УАА УАГ УГА при биосинтез белка?.................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
-
Дайте объяснение данной схемы: ДНК и РНК белок ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………............................................................................................................................................................................
Урок №29
Тема урока: Распад мРНК
Допишите предложения
-
Различают …………………………………………., разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие ……………………………………… ………………………………. с образованием ……………………………, и экзонуклеазы, катализирующие ……………………………отщепление концевых мононуклеотидов.
-
Как называется номер ДНК …………………………………………………………………Какие нуклеотиды входят в макромолекулы РНК ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок №30
Тема урока: Трансляция мРНК у эукариот
Допишите предложения
-
Процесс трансляции ……………………………………… мРНК в основном аналогичен таковому ……………………………………. мРНК. За некоторыми ……………………. ……………………… исключениями, ………………………………………… код универсален и кодоны последовательно ……………………………… с помощью специфических аминоцил тРНК-синтез на рибосомах.
-
Наличие какого мономера РНК отличается от ДНК…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок №31
Трансляция мРНК у прокариот
Допишите предложения
-
При этом ………………………..группа уже образовавшегося участка………………………. цепи соединяется с …………………………….. следующей ……………………………. аминокислоты с помощью ……………………………. связи.
-
Это может……………………………………, лишь если ………………………….. конец растущей ……………………………….. цепи находится в …………………………….. состоянии.
-
Назовите углевод входящий в состав РНК ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Урок №32
Тема урока: Фолдинг белка
Допишите предложения
-
Для стабилизации ……………………………………………………..структуры многие белки в клетке подвергаются ……………………………… модификации. Весьма часто встречаются …………………………………. мостикимежду …………………………….. близкими участками ……………………………………… цепи.
-
Для корректной …………………………… белков весьма важна правильная …………………………….. структура. Ошибки ………………………………… обычно приводят к образованию ………………………………… белка с ……………………………. свойствами.
Урок №33
Тема: Модификация белков
Допишите предложения
-
Характерные особенности этих …………………………………. наличие на конце ……………………………. положительно………………………………………. участка, за которым следует …………………………….. участок, содержащий от 7 до 14 амино кислотных остатков.
-
Для стабилизации …………………………………. структуры многие белки в клетке подвергаются ………………………………….. модификации. Весьма часто встречаются ………………………………….. мостик и между …………………………….. близкими участками ………………………………….. цепи.
Урок №34
Тема урока: Получение антибиотиков.
Допишите предложения
-
Разные микрорганизмы или их штаммы могут………………………………. разные ………………………. формы одного и того же …………………………, например разные ………………………………. или различные формы стрептомицина.
-
В последние годы …………………………………….. и описано ……………………… число антибиотиков,……………………………… различными организмами.
-
Какие микроорганизмы вырабатывают антибиотики…………………………………………………………………………………………………………………………………………………………………………………………………………….…………………………………………………………………………………………………………………………………………………………………………………………
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
«Основы молекулярной биологии»
«Основы молекулярной биологии»
ЖАМБЫЛ ОБЛЫСЫ Т.РЫСҚҰЛОВ АУДАНЫ ӘКІМДІГІНІҢ БІЛІМ БӨЛІМІНІҢ
«АҚТОҒАН ОРТА МЕКТЕБІ» КОММУНАЛДЫҚ МЕМЛЕКЕТТІК МЕКЕМЕСІ
«Қаралды» «Келісемін» «Бекітемін»
әдістемелік бірлестік мектеп директорының Ақтоған орта мектебінің
отырысында ----------- ғылыми әдістемелік ісі директоры ӘБ жетекшісі ---------- жөніндегі орынбасары _____О.М.Рыскулова
---------- Абдезова Д.А. _______Дарменова Э.Т
«_____»____2018ж.
«_____»____2018ж. «-----»--------- 2018 ж.
.
Авторская программа
«Основы молекулярной биологии»
Программа курса для 11классов естественно-математического направления
Когершин 2016
Пояснительная записка
Предлагаемый курс раcчитан 34 часа (1 час в неделю), он охватывает основные разделы и «Молекулярной биологии», которые являются одним из самых сложных для понимания в школьном курсе биологии. Курс поддерживает и углубляет базовые знания по биологии и направлен на формирование и развитие основных учебных компетенций и в правильном выборе профессии.
Умение решать задач по молекулярной биологии, генетики развивает
логическое мышление, позволяет учащимся добиваться получения качественных, углубленных знаний, даёт возможность самоконтроля и самовоспитания. Учитывая результаты анализа ЕНТ закрепления материала, который ежегодно вызывает затруднения: это раздел генетики, Химическая организация клетки; обмен веществ и превращение энергии.
Курс дает возможность лучше познать фундаментальные генетические понятия, отражающие строение и функционирование биологических систем на всех уровнях организации жизни. Основы молекулярной биологии позволяет также углубить и закрепить знания по разделам общей биологии, генетики, микробиологии, медицине и эволюционной теорией. Огромную важность в непрерывном образовании приобретают вопросы самостоятельной работы учащихся, умение мыслить самостоятельно и находить решение. самоконтролю и самооценке. Это формирует творческое отношение к труду важное для человека любой профессии и является важным условием успешного, качественного выполнения им своих обязанностей.
Особенностями программы курса является тесная связь его содержания с уроками общей биологии, химии и соответствие Государственного стандарта
Целью данного курса: является развитие у учащихся умений и навыков решения задач по основным разделам молекулярной биологии.
Задачи курса:
- усвоение основных понятий, терминов и законов генетики;
- применение теоретических знаний на практике;
- развитие интереса к предмету;
- ознакомление с практической значимостью общей биологии для различных отраслей производства. Курс позволяет учащимся подготовиться к сдаче ЕНТ.
После прохождения курса учащиеся должны знать
- основные понятия, термины и законы цитологии и генетики;
- значения молекулярной биологии в медицине;
- решать задачи по курсу цитологии и генетики;
- применении микробиологии в медицине:
Оценивание знания учащихся
В процессе обучения курса, знания учащихся оценивается,
выполнением тестовых заданий и контрольных работ.
Критерий оценок:
Высший уровень 18-20 балов
Достаточный уровень 11-17
Удовлетворительный уровень 5-10
Низкий уровень 1-4
Уровень знания учащихся отслеживается годовым и полугодовым мониторингом. Оценивание проводится формативное и суммативное. В процессе обучения оценивание проводится в виде групповых и индивидуальных работ.
Литература:
-
Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
5-9с
-
Красновидова С.С. Дидактические материалы по общей биологии:
10-11 кл.: Пособие для учащихся общеобразовательных учреждений/ С.С Корасновидова, С.А. Павлов, А.Б. Хватов.- М.: Просвещение, 2000.-159 с
3. Ж.Биология,география Алматы 1999№6 32-35с
4. ж.Биолог анықтамалығы Алматы №2. 2011, с 14-17
5. ж.Биолог анықтамалығы Алматы №8. 2011, с 26-29
6 .Настольная книга учителя биологии/ Авт.-сост. Калинова Г.С.,
Кучменко АСТ»: «ООО Издательство Астрель», 2002.-158 с..
7.Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
36-38с
8.Семенцова В.Н. Биология. Общие закономерности. 9 класс.
Технологические карты уроков: Методическое пособие. –
СПб.:»Паритет», 2002.-192 с.
9. Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
10. Козлова Т.А. Тематическое и поурочное планирование по
биологии. К учебнику А.А. Каменского, Е.А. Криксунова, В.В.
Пасечника «Общая биология: 10-11 классы». М.: Изд-во
«Экзамен», 2006. – 286 с
11. Уч.пос. Общая биология 10кл. авт.Т.Касымбаева
К.Мухамбетжанов Алматы"Мектеп" 2010
12. ж.Биолог анықтамалығы Алматы №4. 2011, с 50-55
Дополнительная литература:
13. Методическое пособие к учебнику В.Б. Захарова, Н. И Сонина
«Биология. Общие закономерности. 10 класс / Т.А. Ловкова, Н.И.
Сонин,– М.: Дрофа, 2003.– 128 с.
14. Биология. Человек/ В.Н. Фросин, В.И. Сивоглазов. – М.: Дрофа,
2003
15. Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
65-66с 15. Ж.Биология,география Алматы 2000 №9 42-45с
16. Биотехнология(уч.пособ.) АубакировХ.А. Карынтаева А.К. 2011г.
137-139с
17. Кочергин Б. Н., Кочергина Н. А. «Задачи по молекулярной
биологии и генетике» (Минск, «Народная асвета», 1982
18. Муртазин Г. М. «Задачи и упражнения по общей биологии
(Москва, 1981г.)
Ресурсы дистанционного обучения
http://www.informika.ru/- обучающих программ по биологии и химии.
http://testipobiologii.ucoz.ru/ - тесты по биологии от учителя биологии Муромцевой Юлии Владимировны (авторский персональный сайт)
http://www.ballov.net/login.php - тесты на странице электронного дневника ballov.net(авторские ресурсы)
Содержание:
І. раздел Синтез ДНК и теломераза – 16
Этот раздел ознакомит учащихся с компонентами ядра, ядерной оболочкой, эволюционным значением ядра, происхождением ядра, молекулярным механизмом, репликацией основной части ДНКа, репликацией теломерных отделов, механизмом действия теломеразы, механизмы действия теломер в соматических клетках, теломеразы, рака и старения, метилирование ДНК, метилирование ДНК у человека, роль метилирования в онкогенезе, репликация повреждений ДНК, повреждение оснований, преждевременная терминация белковой цепи.
ІІ. раздел Экспрессия генов и транскрипционные факторы 14ч.
Этот раздел ознакомит учащихся с строением и функциями хромасом,
организацией генетического материала способами записи, способами записи генетической информации в молекуле ДНК, биологический код и его свойствами, оперонной организацией генетического материала у бактерий,
конститутивными генами и белками, количественными особенностями генома эукариот,
конститутивными генами и белками, гетерогенность ДНК эукариот по нуклеотидному составу, особенностями репликации эукариотических хромосом, структурой РНК,
синтезем РНК, синтезем ДНК, созреванием РНК, распадом мРНК.
ІІІ. раздел Синтез белков, их фолдинг и модификации. 4ч.
Этот раздел ознакомит учащихся с трансляциями мРНК у прокариот, фолдингом белков, модификацией белков, получением антибиотиков
«Основы молекулярной биологии»
Программа курса для 11классов естественно-математического направления
|
№ |
Тема урока |
Часы |
Сроки |
Практические работы. |
|
|
1. Синтез ДНК и теломераза – 16 |
|
|
|
|
1 |
Компоненты ядра |
1 |
|
|
|
2 |
Ядерная оболочка |
1 |
|
|
|
3 |
Эволюционное значение ядра |
1 |
|
|
|
4 |
Происхождение ядра |
1 |
|
Решение задач |
|
5 |
Молекулярный механизм |
1 |
|
|
|
6 |
Репликация основной части ДНК |
1 |
|
|
|
7 |
Репликация теломерных отделов |
1 |
|
|
|
8 |
Механизм действия теломеразы |
1 |
|
|
|
9 |
Механизмы действия теломер в соматических клетках |
1 |
|
|
|
10 |
Теломераза, рак и старение |
1 |
|
|
|
11 |
Метилирование ДНК |
1 |
|
|
|
12 |
Метилирование ДНК у человека |
1 |
|
|
|
13 |
Роль метилирование в онкогенезе |
1 |
|
Решение задач |
|
14 |
Репликация повреждения ДНК |
1 |
|
Решение задач |
|
15 |
Повреждение оснований |
1 |
|
|
|
16 |
Преждевременная терминация белковой цепи |
|
|
|
|
|
2. Экспрессия генов и транскрипционные факторы 14ч. |
1 |
|
Решение задач |
|
17 |
Строение и функции хромасом |
1 |
|
|
|
18 |
Организация генетического материала способ записи |
1 |
|
|
|
19 |
Способ записи генетической информации в молекуле ДНК. Биологический код и его свойства |
1 |
|
|
|
20 |
Оперонная организация генетического материала у бактерий. |
1 |
|
|
|
21 |
Конститутивные гены и белки |
1 |
|
|
|
22 |
Количественные особенности генома эукариот
|
1 |
|
Решение задач |
|
23 |
Конститутивные гены и белки |
1 |
|
|
|
24 |
Гетерогенность ДНК эукариот по нуклеотидному составу |
1 |
|
|
|
25 |
Особенности репликации эукариотических хромосом |
1 |
|
Решение задач |
|
26 |
Структура РНК |
1 |
|
Решение задач |
|
27 |
Синтез РНК |
1 |
|
Решение задач |
|
28 |
Синтез ДНК |
1 |
|
Решение задач |
|
29 |
Созревание РНК |
1 |
|
|
|
30 |
Распад мРНК |
1 |
|
|
|
|
3. Синтез белков, их фолдинг и модификации. 4ч. |
|
|
|
|
31 |
Трансляция мРНК у прокариот |
1 |
|
|
|
32 |
Фолдинг белков |
1 |
|
|
|
33 |
Модификация белков |
1 |
|
|
|
34 |
Получение антибиотиков |
1 |
|
|
ЖАМБЫЛ ОБЛЫСЫ Т.РЫСҚҰЛОВ АУДАНЫ ӘКІМДІГІНІҢ БІЛІМ БӨЛІМІНІҢ
«АҚТОҒАН ОРТА МЕКТЕБІ» КОММУНАЛДЫҚ МЕМЛЕКЕТТІК МЕКЕМЕСІ
.
«Основы молекулярной биологии»
Методическое руководство
11 класс
Учитель биологии Ахимбекова Айман Несипбаевна
Урок №1
Тема урока Компоненты ядра – 2ч
Цель: развивать и углублять знания по темекомпоненты ядра
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новаятема:
Ядро (лат. nucleus) — это один из структурных компонентов эукариотической клетки, содержащий генетическую
информацию (молекулы ДНК),
осуществляющий основные функции: хранение, передача и реализация
наследственной информации с обеспечением синтеза белка. Ядро состоит
из хромати́на, я́дрышка, кариопла́змы(или нуклеоплазмы)
и ядерной оболочки. В клеточном ядре
происходит репликация (или редуплика́ция) —
удвоение молекул ДНК, а также транскрипция —
синтез молекул РНК на молекуле
ДНК. Синтезированные в ядре молекулы РНК модифицируются, после чего
выходят в цитоплазму. Образование обеих
субъединиц рибосом происходит в специальных
образованиях клеточного ядра — ядрышках. Таким образом, ядро клетки
является не только вместилищем генетической информации, но и
местом, где этот материал функционирует и воспроизводится.
Тонкая структура клеточного ядра
Схема строения клеточного ядра.
Хроматин
Огромная длина молекул ДНК эукариот предопределила появление специальных механизмов хранения, репликации и реализации генетического материала. Хроматином называют молекулы хромосомной ДНК в комплексе со специфическими белками, необходимыми для осуществления этих процессов. Основную массу составляют «белки хранения», так называемые гистоны. Из этих белков построены нуклеосомы — структуры, на которые намотаны нити молекул ДНК. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырёх типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь белков. Гистон H1, более крупный чем другие гистоны, связывается с ДНК в месте её входа на нуклеосому. Нуклеосома вместе с H1 называется хроматосомой.
Схема, показывающая цитоплазму, вместе с её компонентами
(или органеллами), в типичной
животнойклетке. Органеллы:
(1) Ядрышко
(2) Ядро
(3) рибосома (маленькиеточки)
(4) Везикула
(5)шероховатый эндоплазматическийретикулум(ER)
(6) АппаратГольджи
(7) Цитоскелет
(8)Гладкий эндоплазматический
ретикулум
(9) Митохондрия
(10) Вакуоль
(11) Цитоплазма
(12) Лизосома
(13) Центриоль и Центросома
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно, его называют конденсированным или гетерохроматином, он хорошо виден под микроскопом. ДНК, находящаяся в гетерохроматине, не транскрибируется, обычно это состояние характерно для незначимых или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки. Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием.
Считается, что в ядре существуют так называемые функциональные домены хроматина(ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». К сожалению, вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №2
Тема урока: Ядерная оболочка, ядерная ламина и ядерные поры (кариолемма)
Цель: развивать и углублять знания по темеядерная оболочка, ядерная ламина и ядерные поры
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема: От цитоплазмы ядро отделено ядерной оболочкой, образованной за счёт расширения и слияния друг с другом цистерн эндоплазматической сети таким образом, что у ядра образовались двойные стенки за счёт окружающих его узких компартментов. Полость ядерной оболочки называется люменом или перинуклеарным пространством. Внутренняя поверхность ядерной оболочки подстилается ядерной ламиной, жёсткой белковой структурой, образованной белками-ламинами, к которой прикреплены нити хромосомной ДНК. Ламины прикрепляются к внутренней мембране ядерной оболочки при помощи заякоренных в ней трансмембранных белков — рецепторов ламинов. В некоторых местах внутренняя и внешняя мембраны ядерной оболочки сливаются и образуют так называемые ядерные поры, через которые происходит материальный обмен между ядром и цитоплазмой. Пора не является дыркой в ядре, а имеет сложную структуру, организованную несколькими десятками специализированных белков — нуклеопоринов. Под электронным микроскопом она видна как восемь связанных между собой белковых гранул с внешней и столько же с внутренней стороны ядерной оболочки.
Различные структуры клеточного ядра видны из-за накопления в них зелёного флуоресцентного белка
Ядрышко находится внутри ядра, и не имеет собственной мембранной оболочки, однако хорошо различимо под световым и электронным микроскопом. Основной функцией ядрышка является синтезрибосом. В геноме клетки имеются специальные участки, так называемые ядрышковые организаторы, содержащие гены рибосомной РНК (рРНК), вокруг которых и формируются ядрышки. В ядрышке происходит синтез рРНК РНК полимеразой I, её созревание, сборка рибосомных субчастиц. В ядрышке локализуются белки, принимающие участие в этих процессах. Некоторые из этих белков имеют специальную последовательность — сигнал ядрышковой локализации (NoLS, от англ. NucleolusLocalization Signal). Следует отметить, самая высокая концентрация белка в клетке наблюдается именно в ядрышке. В этих структурах было локализовано около 600 видов различных белков, причем считается, что лишь небольшая их часть действительно необходима для осуществления ядрышковых функций, а остальные попадают туда неспецифически.
Под электронным микроскопом в ядрышке выделяют несколько субкомпартментов. Так называемые Фибриллярные центры окружены участками плотного фибриллярного компонента, где и происходит синтез рРНК. Снаружи от плотного фибриллярного компонента расположен гранулярный компонент, представляющий собой скопление созревающих рибосомных субчастиц.
Ядерный матрикс
Ядерным матриксом некоторые исследователи называют нерастворимый внутриядерный каркас. Считается, что матрикс построен преимущественно из негистоновыхбелков, формирующих сложную разветвленную сеть, сообщающуюся с ядерной ламиной. Возможно, ядерный матрикс принимает участие в формировании функциональных доменов хроматина. В геноме клетки имеются специальные незначащие А-Т-богатые участки прикрепления к ядерному матриксу (англ. S/MAR —Matrix/Scaffold Attachment Regions), служащие, как предполагается, для заякоривания петель хроматина на белках ядерного матрикса. Впрочем, не все исследователи признают существование ядерного матрикса.
Принципиальная схема реализации
генетической информации у про- и эукариот.
ПРОКАРИОТЫ. У прокариот синтез белка рибосомой (трансляция)
пространственно не отделен от транскрипции и может происходить ещё до завершения
синтеза мРНК РНК-полимеразой.
Прокариотические мРНК часто полицистронные, то
есть содержат несколько независимых генов.
ЭУКАРИОТЫ. мРНК эукариот синтезируется в виде предшественника, пре-мРНК,
претерпевающего затем сложное стадийное
созревание — процессинг,
включающий присоединениекэп-структуры
к 5'-концу
молекулы, присоединение нескольких десятков
остатков аденина к
её 3'-концу
(полиаденилирование), выщепление незначащих
участков — интронов и
соединение друг с другом значащих
участков — экзонов (сплайсинг). При
этом соединение экзонов одной и той же пре-мРНК может проходить
разными способами, приводя к образованию разных зрелых мРНК, и в
конечном итоге разных вариантов белка (альтернативный сплайсинг).
Только мРНК, успешно прошедшая процессинг, экспортируется из ядра в
цитоплазму и вовлекается в трансляцию.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №3
Тема урока: Эволюционное значение ядра
Цель: развивать и углублять знания по темеэволюционное значение ядра
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема:
Основное функциональное отличие клеток эукариот от клеток прокариот заключается в пространственном разграничении процессов транскрипции (синтеза матричной РНК) и трансляции(синтеза белка рибосомой), что дает в распоряжение эукариотической клетки новые инструменты регуляции биосинтеза и контроля качества мРНК.
В то время, как у прокариот мРНК начинает транслироваться ещё до завершения её синтеза РНК-полимеразой, мРНК эукариот претерпевает значительные модификации (так называемый процессинг), после чего экспортируется через ядерные поры в цитоплазму, и только после этого может вступить в трансляцию. Процессинг мРНК включает несколько элементов.
Из предшественника мРНК (пре-мРНК) в ходе процесса, называемого сплайсингом вырезаютсяинтроны — незначащие участки, а значащие участки — экзоны соединяются друг с другом. Причем экзоны одной и той же пре-мРНК могут быть соединены несколькими разными способами (альтернативный сплайсинг), так что один предшественник может превращаться в зрелые мРНК нескольких разных видов. Таким образом, один ген может кодировать сразу несколько белков.
Кроме того, интрон-экзонная структура генома, практически невозможная у прокариот (так как рибосомы смогут транслировать незрелые мРНК), дает эукариотам определенную эволюционнуюмобильность. Учитывая протяженность интронных участков, рекомбинация между двумя генами зачастую сводится к обмену экзонами. Благодаря тому, что экзоны часто соответствуют функциональным доменам белка, участки получившегося в результате рекомбинации «гибрида», зачастую сохраняют свои функции. В то же время у прокариот рекомбинация между генами невозможна без разрыва в значащей части, что безусловно уменьшает шансы на то, что получившийся белок будет функционален.
Модификациям подвергаются концы молекулы мРНК. К 5' -концу молекулы прикрепляется 7-метилгуанин (так называемый кэп). К 3'-концу нематрично присоединяются несколько десятков остатковаденина (полиаденирование).
Процессинг мРНК тесно сопряжен с синтезом этих молекул и необходим для контроля качества. Непроцессированная или не полностью процессированная мРНК не сможет выйти из ядра в цитоплазму или будет нестабильна и быстро деградирует. У прокариот нет таких механизмов контроля качества, и из-за этого прокариотические мРНК имеют меньший срок жизни — нельзя допустить, чтобы неправильно синтезированная молекула мРНК, если такая появится, транслировалась в течение долгого времени.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №4
Тема урока: Происхождение ядра
Цель: развивать и углублять знания по темепроисхождение ядра
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учеников к уроку
Новая тема: Клеточное ядро является важнейшей чертой эукариотических организмов, отличающей их от прокариот и архей. Несмотря на значительный прогресс в цитологии и молекулярной биологии, происхождение ядра не выяснено и является предметом научных споров. Выдвинуто 4 основных гипотезы происхождения клеточного ядра, но ни одна из них не получила широкой поддержки
Гипотеза, известная как «синтропная модель», предполагает что ядро возникло в результате симбиотических взаимоотношений между археей и бактерией (ни археи, ни бактерии не имеют оформленных клеточных ядер). По этой гипотезе, симбиоз возник, когда древняя архея (сходная с современными метаногенными археями), проникла в бактерию (сходную с современными Миксобактериями). Впоследствии архея редуцировалась до клеточного ядра современных эукариот. Эта гипотеза аналогична практически доказанным теориям происхождения митохондрий и хлоропластов, которые возникли в результате эндосимбиоза прото-эукариот и аэробных бактерий Доказательством гипотезы является наличие одинаковых генов у эукариот и архей, в частности генов гистонов. Также миксобактерии быстро передвигаются, могут образовывать многоклеточные структуры и имеют киназы и G-белки, близкие к эукариотическим.
Согласно второй гипотезе, прото-эукариотическая клетка эволюционировала из бактерии без стадии эндосимбиоза. Доказательством модели является существование современных бактерий из отряда Planctomycetes, которые имеют ядерные структуры с примитивными порами и другие клеточные компартменты, ограниченные мембранами (ничего похожего у других прокариот не обнаружено).Согласно гипотезе вирусного эукариогенеза, окруженное мембраной ядро, как и другие эукариотические элементы, произошли вследствие инфекции прокариотической клетки вирусом. Это предположение основывается на наличии общих черт у эукариот и некоторых вирусов, а именно геноме из линейных цепей ДНК, кэпировании мРНК и тесном связывании генома с белками (гистоны эукариот принимаются аналогами вирусных ДНК-связывающих белков). По одной версии, ядро возникло прифагоцитировании (поглощении) клеткой большого ДНК-содержащего вируса. По другой версии, эукариоты произошли от древних архей, инфицированныхпоксвирусами. Эта гипотеза основана на сходстве ДНК-полимеразы современных поксвирусов и эукариот Также предполагается, что нерешенный вопрос о происхождении пола и полового размножения может быть связан с вирусным эукариогенезом.
Наиболее новая гипотеза, названная экзомембранной гипотезой, утверждает, что ядро произошло от одиночной клетки, которая в процессе эволюции выработала вторую внешнюю клеточную мембрану; первичная клеточная мембрана после этого превратилась в ядерную мембрану, и в ней образовалась сложная система поровых структур (ядерных пор) для транспорта клеточных компонентов, синтезированных внутри ядра.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №5
Тема урока: Молекулярный механизм репликации
Цель урока: развивать и углублять знания по темемолекулярный механизм репликации
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема: Ферменты (хеликаза, топоизомераза) и ДНК-связывающие белки расплетают ДНК, удерживают матрицу в разведённом состоянии и вращают молекулу ДНК. Правильность репликации обеспечивается точным соответствием комплементарных пар оснований и активностью ДНК-полимеразы, способной распознать и исправить ошибку. Репликация у эукариот осуществляется несколькими разными ДНК-полимеразами. ДНК-полимераза I действует на запаздывающей цепи для удаления РНК-праймеров и дорепликации очищенных мест ДНК. ДНК полимераза III — основной фермент репликации ДНК, осуществляющий синтез ведущей цепи ДНК и фрагментов Оказаки при синтезе запаздывающей цепи. Далее происходит закручивание синтезированных молекул по принципу суперспирализации и дальнейшей компактизации ДНК. Синтез энергозатратный.
Цепи молекулы ДНК расходятся, образуют репликационную вилку, и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две новые двуспиральные молекулы ДНК, идентичные родительской молекуле.
Характеристики процесса репликации
-
матричный — последовательность синтезируемой цепи ДНК однозначно определяется последовательностью материнской цепи в соответствии с принципом комплементарности;
-
полуконсервативный — одна цепь молекулы ДНК, образовавшейся в результате репликации, является вновь синтезированной, а вторая — материнской;
-
идёт в направлении от 5’-конца новой молекулы к 3’-концу;
-
полунепрерывный — одна из цепей ДНК синтезируется непрерывно, а вторая — в виде набора отдельных коротких фрагментов (фрагментов Оказаки);
-
начинается с определённых участков ДНК, которые называются сайтами инициации репликации (англ. origin)
Особенности репликации
1. Для эукариотических клеток характерно наличие множества точек начала репликации. Одновременное удвоение ДНК во многих участках значительно сокращает продолжительность всего процесса.
Точка начала репликации имеет специфическую последовательность оснований, богатую парами А – Т, что, вероятно, облегчает разделение цепей. Отрезок ДНК, репликация которого протекает под контролем одной точки начала репликации, образует репликон. В каждом репликоне присутствуют точка инициации (область начала репликации, от англ. replication origin – ori) и точка окончания (terminalis).
2. Репликация распространяется в обе стороны от каждой точки начала репликации. При этом образуются две репликативные вилки, движущиеся в противоположных направлениях (ранняя стадия репликации,
рис. 1). Между репликативными вилками появляется постепенно расширяющийся «глазок»: это уж реплицированные отделы ДНК. В итоге соседние зоны репликации («глазки») сливаются, и вся молекула ДНК оказывается удвоенной (поздняя стадия репликации, рис. 1).

Рис. 1. Множественная двунаправленная репликация эукариотической ДНК

Рис. 2. Репликативная вилка
3. Движение репликативной вилки сопровождается одновременным считыванием двух матричных цепей. Поскольку синтез дочерних цепей ДНК осуществляется антипараллельно матричным и всегда в направлении 5′®3′, то лишь одна дочерняя цепь ДНК будет синтезироваться непрерывно. Эта цепь называется ведущей или лидирующей. Направление ее синтеза совпадает с направлением расплетания двойной спирали (рис. 2). На второй матричной цепи ДНК синтезируется сравнительно короткими фрагментами, названными фрагментами Оказаки (1000-2000 нуклеотидов у прокариот и 100-200 нуклеотидов в реплицирующейся ДНК эукариот). Синтез каждого фрагмента Оказаки также идет в направлении 5′®3′. В виде фрагментов Оказаки синтезируется та цепь, направление образования которой противоположно движению соответствующей репликативной вилки. Эта цепь называется отстающей или запаздывающей.
Рис. 2. Репликативная вилка
4. Образованию каждого нового фрагмента ДНК (как длинного фрагмента ведущей цепи, так и любого из фрагментов Оказаки отстающей цепи) предшествует синтез короткой последовательности РНК-затравки (праймера) из 10-15 нуклеотидов. Основной фермент, синтезирующий ДНК (ДНК-полимераза), не может начинать процесс «с нуля», а лишь достраивает 3′-конец уже имеющейся нуклеотидной последовательности. В противоположность этому, фермент ДНК-праймаза такой способностью обладает. Через некоторое время РНК-затравки удаляются и образовавшиеся бреши застраиваются ДНК-полимеразой. В дальнейшем все многочисленные фрагменты ДНК, образованные на одной родительской цепи, сшиваются специальным ферментом ДНК-лигазой в одну непрерывную цепь.
Процесс репликации осуществляется сложным ферментным комплексом, включающим 15-20 белков, которые условно разделяют на три группы.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №6
Тема урока:Репликация основной части ДНК
Цель урока: развивать и углублять знания по темерепликация основной части ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема: Реплика́ция (от лат. replicatio — возобновление) — процесс синтеза дочерней молекулыдезоксирибонуклеиновой кислоты на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15—20 различных белков, называемый реплисомой
Схематическое изображение процесса репликации, цифрами отмечены: (1) запаздывающая нить, (2) лидирующая нить, (3) ДНК-полимераза (Polα), (4) ДНК-лигаза, (5) РНК-праймер, (6) праймаза, (7) фрагмент Оказаки, (8) ДНК-полимераза (Polδ), (9) хеликаза, (10) одиночная нить со связанными белками, (11)топоизомераза
Процесс репликации: раскручивание двойной спирали ДНК — синтез комплементарных цепей ДНК-полимеразой — образование двух молекул ДНК из одной.
Каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Такой механизм репликации называется полуконсервативным. В настоящее время этот механизм считается доказанным благодаряопытам Мэтью Мезельсона и Франклина Сталя (1958 г.). Ранее существовали и две другие модели: «консервативная» — в результате репликации образуется одна молекула ДНК, состоящая только из родительских цепей, и одна, состоящая только из дочерних цепей; «дисперсионная» — все получившиеся в результате репликации молекулы ДНК состоят из цепей, одни участки которых вновь синтезированы, а другие взяты из родительской молекулы ДНК.
Репликация ДНК — ключевое событие в ходе деления клетки. Принципиально, чтобы к моменту деления ДНК была реплицирована полностью и при этом только один раз. Это обеспечивается определёнными механизмами регуляции репликации ДНК. Репликация проходит в три этапа:
-
инициация репликации
-
элонгация
-
терминация репликации.
Регуляция репликации осуществляется в основном на этапе инициации. Это достаточно легко осуществимо, потому что репликация может начинаться не с любого участка ДНК, а со строго определённого, называемого сайтом инициации репликации. Вгеноме таких сайтов может быть как всего один, так и много. С понятием сайта инициации репликации тесно связано понятиерепликон. Репликон — это участок ДНК, который содержит сайт инициации репликации и реплицируется после начала синтеза ДНК с этого сайта. Геномы бактерий, как правило, представляют собой один репликон, это значит, что репликация всего генома является следствием всего одного акта инициации репликации. Геномы эукариот (а также их отдельные хромосомы) состоят из большого числа самостоятельных репликонов, это значительно сокращает суммарное время репликации отдельной хромосомы. Молекулярные механизмы, которые контролируют количество актов инициации репликации в каждом сайте за один цикл деления клетки, называются контролем копийности. В бактериальных клетках помимо хромосомной ДНК часто содержатся плазмиды, которые представляют собой отдельные репликоны. У плазмид существуют свои механизмы контроля копийности: они могут обеспечивать синтез как всего одной копии плазмиды за клеточный цикл, так и тысяч копий.
Репликация начинается в сайте инициации репликации с расплетания двойной спирали ДНК, при этом формируется репликационная вилка — место непосредственной репликации ДНК. В каждом сайте может формироваться одна или две репликационные вилки в зависимости от того, является ли репликация одно- или двунаправленной. Более распространена двунаправленная репликация. Через некоторое время после начала репликации в электронный микроскоп можно наблюдать репликационный глазок — участок хромосомы, где ДНК уже реплицирована, окружённый более протяжёнными участками нереплицированной ДНК
В репликационной вилке ДНК копирует крупный белковый комплекс (реплисома), ключевым ферментом которого является ДНК-полимераза. Репликационная вилка движется со скоростью порядка 100 000 пар нуклеотидов в минуту у прокариот и 500—5000 — у эукариот
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Дата: 13.10.16
Урок №7
Тема урока: Репликация теломерных отделов
Цель: развивать и углублять знания по темерепликация теломерных отделов ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая
тема: Теломераза – это
фермент‚ синтезирующий тандемно повторяющиеся сегменты ДНК, из
которых состоит G-цепь теломерной ДНК.
она относится к классу ДНК-полимераз
- теломераза - это РНК-зависимая ДНК-полимераза или обратная
транскриптаза.
- Ферменты этого класса, синтезирующие ДНК на РНК-матрицах, очень
хорошо известны молекулярным биологам. Они закодированы и
содержатся в ретровирусах (например, в вирусе иммунодефицита
человека, вызывающем заболевание СПИДом) и служат для синтеза
ДНК-копий их геномов, который в ретровирусе представлен
РНК.
- В клеточном геноме обратные транскриптазы закодированы в
ретротранспозонах.
- РНК, используемая теломеразой для синтеза теломерной ДНК в
качестве матрицы, входит в состав этого фермента. В этом
уникальность теломеразы: на сегодня это единствення известная
РНК-содержащая обратная транскриптаза.
- Теломеразные РНК у разных организмов сильно различаются по длине
и структуре.
- Теломеразы простейших содержат РНК длиной в 150-200 нуклеотидных
остатков (н.о.),
- длина теломеразной РНК человека - 450 н.о.,
- теломераза дрожжей содержит аномально длинную РНК (около 1300
н.о.).
- Как и любая другая РНК клетки, теломеразная РНК обладает
специфической вторичной и третичной структурой. Вторичная структура
изолированной теломеразной РНК достоверно установлена только для
теломераз простейших. Пространственная структура теломеразной РНК в
составе ферментативного комплекса пока еще неизвестна.
- Матричный участок представлен в теломеразной РНК только один раз.
Его длина не превышает длину двух повторов в теломерной ДНК,
которые он кодирует и которым он, разумеется,
комплементарен.
- Так как теломераза синтезирует сегменты ДНК, повторяющиеся много
раз, используя только один сегмент своей РНК, она должна обладать
способностью периодически (после завершения синтеза каждого
повтора) перемещать (транслоцировать) матричный участок в район
3'-конца синтезируемой теломерной ДНК. Источником энергии для
такого перемещения, по-видимому, служит сама реакция синтеза цепи
теломерной ДНК, поскольку дезоксинуклеозидтрифосфаты - субстраты
этой реакции - высокоэнергетические вещества.
Такое удлинение возможно, потому что концы хромосом содержат
повторы из нескольких нуклеотидов (например, у человека ТТАGGG),
которым комплементарен участок РНК - компонента теломеразы. Таким
образом, теломераза узнает выступающий 3'-конец и удлиняет его. В
таком случае удается, снова с использованием ДНК-затравки и
РНК-матрицы, достроить конец ДНК Теломеразная машина устроена таким
образом, что конец хромосомы может не только сохраняться, но и
удлиняться в ряду поколений. Действительно, последнее нетрудно себе
представить, если достраиваемый 3'-конец будет достаточно длинным.
Одна из причин старения видится в том, что при отсутствии
теломеразы в некоторых тканях происходит укорачивание хромосомы с
потерей важных генов. Наоборот, бессмертие ряда клеток в культуре
вне организма, свойственное, как правило, клеткам из опухолей,
объясняется реактивацией теломеразы. Мы кратко рассмотрели эту
интересную проблему, связанную с активностью теломеразы и вечными
проблемами биологического старения и опухолевого роста, поскольку
оказалось, что иногда в борьбу с укорочением концов хромосом
вступают мобильные элементы. У плодовой мушки дрозофилы отсутствует
теломеразная машина, но концы ДНК удлиняются за счет перемещений
ретротранспозонов. На этом примере впервые показана важная
структурная и функциональная роль ретротранспозонов. Они выступают
как компоненты генома, спасающие хромосому от укорачивания. В
качестве спасателей выступают ретротранспозоны, относящиеся к
семействам, без длинных концевых повторов. Ретротранспозоны
перемещаются, образуя повторяющуюся структуру, в которой элементы
соединены друг с другом по типу "голова к хвосту" Сначала на
РНК-транскрипте как на матрице с помощью ревертазы строится
комплементарная нить ДНК, а затем после удаления РНК-матрицы
достраивается другая. Таким образом, если эти ретротранспозоны и
существовали когда-то как элементы-паразиты, то впоследствии геном
хозяина приспособил их для выполнения столь важной функции, как
сохранение концевых участков хромосом. Эти ретротранспозоны стали
уже не эгоистами, а бесценными помощниками, спасающими хромосому от
потери генов.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №8
Тема урока: Механизм действия теломеразы
Цель урока: развивать и углублять знания о механизме действия теломеразы
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема:
1.
На первой стадии теломераза находит 3'-конец теломерной ДНК, с
которым часть матричного участка теломеразной РНК образует
комплементарный комплекс. При этом теломераза используети 3'-конец хромосомной ДНК в качестве
праймера.
2. Далее наступает очередь РНК-зависимой
ДНК-полимеразной активности теломеразы. Она обеспечивается
специальной субъединицей теломеразы, которая по устройству своего
каталитического центра во многом сходна с обратными транскриптазами
ретровирусов и ретротранспозонов.
3. Когда синтез ДНК-повтора заканчивается,
происходит транслокация, то есть перемещение матрицы и белковых
субъединиц фермента на заново синтезированный конец теломерной ДНК,
и весь цикл повторяется вновь.
Знакомство даже с весьма схематичным описанием механизма
теломеразной реакции приводит к заключению, что двумя компонентами
- обратной транскриптазой и теломеразной РНК - для ее осуществления
обойтись нельзя.
Нет сомнений в том, что в его составе должны быть субъединица,
отвечающая за поиск и связывание 3'-конца хромосомы (и выполняющая
таким образом своеобразную якорную функцию); субъединица,
ответственная за транслокацию; субъединицы, связывающие продукт
реакции (однотяжевую ДНК). В составе теломеразы обычно
обнаруживается и белковая субъединица с нуклеазной активностью,
которая, по-видимому, отщепляет от 3'-конца теломерной ДНК один за
другим несколько нуклеотидов до тех пор, пока на этом конце не
окажется последовательность, комплементарная нужному участку
матричного сегмента теломеразной РНК. Эти субъединицы теломеразы,
выполняющие разнообразные функции в ходе синтеза G-цепи теломерной
ДНК, изображены на рис. 4, на котором приведена гипотетическая
структура теломеразы дрожжей. Нужно еще раз подчеркнуть, что полный
белковый состав фермента не известен до сих пор ни в одном случае.
Широкое распространение теломераз среди эукариот говорит о том, что
механизм синтеза теломерной ДНК, который мы наблюдаем у современных
организмов, возник очень давно. Более того,
эволюционно-генетический сравнительный анализ нуклеотидных
последовательностей генов каталитических субъединиц теломераз и
других обратных транскриптаз показывает, что этот механизм мог
существовать еще до появления первых эукариотических
клеток.
С-цепь теломерной ДНК синтезируется с помощью обычной
ДНК-полимеразы Поэтому 3'-концевой участок G-цепи, на котором,
по-видимому, первоначально была РНК-затравка, в конечном итоге
остается в однотяжевом состоянии (то есть в принципе он готов к
тому, чтобы теломераза нарастила на нем новый повтор).
Активность теломеразы у высших эукариот обнаружена лишь в трех
типах клеток:
- генеративных,
- раковых
- линиях иммортализованных клеточных культур.
половых и стволовых клетках. В остальных типах клеток синтез этого
фермента прекращается еще в эмбриональный период развития
В организме при дифференцировке клеток теломераза репрессируется.
Экспрессию теломеразы считают фактором иммортализации клеток.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №9
Тема: Механизм действия теломеразы в соматических клетках
Цель: развивать и углублять знания по темемеханизм действия теломеразы в соматических клетках
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая
тема: В соматических
клетках, культивируемых in vitro, теломераза не работает и теломеры
постепенно укорачиваются. Длина теломер достоверно коррелирует с
пролиферативным потенциалом (например, в фибробластах человека).
Укорочение теломер может играть роль митотических часов,
отсчитывающих число делений клетки. По достижении критической длины
теломерной ДНК запускаются процессы остановки клеточного цикла.
Блок клеточных делений наступает еще до того, как теломера исчезла
вовсе. Существует некоторая минимальная длина теломеры, когда
деление еще разрешено. Иными словами, прекращение деления наступает
до того, как начал разрушаться смысловой текст генома. Таким
способом эукариоты страхуют себя от появления монстров вследствие
недорепликации ДНК.
Опубликованная в 1998 году в журнале "Science" статья американских
исследователей благодаря средствам массовой информации привлекла
внимание не только ученых (а в первую очередь не ученых) в связи с
проблемами старения и "клеточного бессмертия". В этой прекрасной
работе коллектива, возглавляемого Джерри Шеем, удалось на 40%
увеличить число делений нормальных соматических клеток человека в
культуре. С помощью генно-инженерных методов в клетки был введен
ген каталитической белковой субъединицы теломеразы и прилегающий к
нему участок ДНК, регулирующий его работу. При активной работе гена
увеличивался как размер теломерной ДНК, так и продолжительность
жизни клеточных культур. Сверх обычных 50 делений клетки прошли
дополнительно 20 делений.
Укорочение теломер можно рассматривать как молекулярный индикатор
количества делений, но не старения клетки. Так, на культуре
нормальных фибробластов человека, взятых от доноров в возрасте от 0
до 93 лет, выявили корреляцию между начальной длиной теломер и
пролиферативной способностью клетки во всем диапазоне возрастов. А
размер теломерной ДНК сперматозоидов не уменьшался в соответствии с
возрастом мужчины, что говорит об экспрессии теломеразы в линии
половых клеток. Прекращение работы теломеразы, отмечаемое в
подавляющем большинстве дифференцированных соматических клеток
животных, является свидетельством их зрелости, а стало быть, и
неизбежно следующих затем процессов увядания и гибели.
Старение особи - это нормальная биологическая функция,
способствующая прогрессивной эволюции вида, размножающегося половым
путем. Давление естественного отбора ослабевает после достижения
животным репродуктивного успеха, поскольку существование особи
после этого имеет меньшее значение для вида. Смерть от старости
удаляет из популяции выполнивших свою роль предков и дает простор
потомкам - носителям новых полезных признаков. Как любая важная
биологическая функция, старение обусловлено параллельным действием
нескольких молекулярных механизмов. Выключение теломеразы - лишь
один из них.
Не стоит рассматривать гены, кодирующие белковые субъединицы
теломеразы и входящую в ее состав РНК, как "гены бессмертия".
Поддержание длины теломерной ДНК на определенном уровне зависит не
только от взаимодействия с ней теломеразы и теломерсвязывающих
белков, но и некоторых, пока неизвестных факторов, регулирующих
образование самих компонентов теломеробразующего
комплекса.
Вряд ли бессмертие, достигнутое раковыми клетками, размножающимися
в культуре десятилетиями без укорочения теломер, - это то, к чему
нужно стремиться. Лекарства от смерти нет. Но тот факт, что
введение в такие клетки препаратов, связывающих РНК-компонент
теломеразы, приводит к укорочению теломер с последующей гибелью
клеток, вселяет надежду на появление новых средств борьбы с
раком.
Понимание механизма работы теломеразы, а главное, регуляции
экспрессии ее в клетке приблизит нас к пониманию процессов и
злокачественной трансформации и старения.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №10
тема урока: Теломераза, рак и старение.
Цель: развивать и углублять знания по теметеломераза, рак и старение.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая
тема:
Вопрос о том, в какой мере теломерный механизм участвует в старении
многоклеточных организмов. Вполне возможно, что они изобрели совсем
иные программы старческого феноптоза. Однако несомненно, что у
людей - рекордсменов по долгожительству уменьшение длины теломер
уже приближается к той роковой черте, за которой наступает запрет
на размножение клеток. Так, по данным группы К. Сасаджимы из
Японии, теломеры в клетках печени стариков старше 80 лет
оказываются почти вдвое короче, чем у детей до 8 лет. По-видимому,
продлить жизнь тем, кому за 100, можно лишь при условии, что
удастся нарастить их теломеры, включив на какое-то время теломеразу
в печени и других тканях, где этот фермент выключился еще во время
эмбрионального развития.
Высокая теломеразная активность наблюдается в половых клетках
человека в течение всей его жизни. Соответственно их теломеры
состоят из наибольшего числа ДНК-повторов и содержат все
необходимые белки для нормальной пролиферации клеток. Аналогичная
ситуация наблюдается и для стволовых клеток. Напомним, что
стволовые клетки делятся неограниченно долго. Однако у стволовой
клетки всегда есть возможность дать две дочерние клетки, одна из
которых останется стволовой ("бессмертной"), а другая вступит в
процесс дифференцировки. Благодаря этому стволовые клетки служат
постоянным источником разнообразных клеток организма. Например,
стволовые клетки костного мозга дают начало гемопоэзу - процессу
образования клеток крови, а из базальных клеток эпидермиса
происходят разнообразные клетки кожного покрова. Как только потомки
половых или стволовых клеток начинают дифференцироваться,
активность теломеразы падает и их теломеры начинают укорачиваться.
В клетках, дифференцировка которых завершена, активность теломеразы
падает до нуля, и, как мы уже отмечали, с каждым клеточным делением
они с неизбежностью приближаются к состоянию сенесенса (перестают
делиться). Вслед за этим наступает кризис, и большинство клеток
погибают Эта картина характерна для подавляющего большинства
известных культур клеток эукариот. Однако и здесь есть редкие, но
важные исключения: теломеразная активность обнаруживается в таких
"смертных" клетках, как макрофаги и лейкоциты.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Тема урока: Метилирование ДНК
Цель урока:развивать и углублять знания по темеметилирование ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка учащихся к уроку
Новая тема:
Метилирование ДНК — это модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома
Метилирование ДНК заключается в присоединении метильной группы к цитозину в составе CpG-динуклеотида в позиции С5 цитозинового кольца. Метилированный цитозин может затем окисляться особыми ферментами, что в конечном итоге приводит к его деметилированию обратно в цитозин[4].
Метилирование ДНК считается, в основном, присущим эукариотам. У человека метилировано около 1 % геномной ДНК. В соматических клетках взрослого организма метилирование ДНК обычно происходит в CpG-динуклеотидах; метилирование ДНК вне CpG-динуклеотидов встречается в эмбриональных стволовых клетках.
Более того, метилирование ДНК вне CpG-динуклеотидов является отличительной чертой эпигенома плюрипотентных стволовых клеток, а снижение не-CG метилирования связано с нарушением способности к дифференцировке в энтодермальные линии клеток[7]
У растений метилирование цитозина происходит как симметрично по обеим цепям (на CpG или CpNpG), так и асимметрично лишь на одной из двух цепей (на CpNpNp, где N обозначает любой нуклеотид).
Отрезок молекулы ДНК, в центре которого находятся два симметрично (по обеим цепям) расположенных метилцитозина в составе CpG-динуклеотидов.
ДНК у млекопитающихОколо 60—70 % всех CpG-динуклеотидов у млекопитающих метилированы. Неметилированные CpG-динуклеотиды сгруппированы в т. н. «CpG-островки», которые присутствуют в 5' регуляторных областях многих генов. Различные заболевания, например, рак, сопровождаются начальным аномальным гипометилированием ДНК и последующим гиперметилированием CpG-островков в промоторных областях генов, что приводит к устойчивой репрессии транскрипции. Репрессия транскрипции в этом случае опосредована белками, которые способны связываться с метилированными CpG-динуклеотидами. Эти белки, называемые метилцитозин-связывающими белками, привлекают деацетилазу гистонов (HDAC) и другие факторы, участвующие в ремоделировании хроматина. Сформировавшийся комплекс может модифицировать гистоны, формируя конденсированную транскрипционно неактивную структуру гетерохроматина. Влияние метилирования ДНК на структуру хроматина имеет большое значение для развития и функционирования живого организма. В частности, отсутствие метилцитозин-связывающего белка 2 (MeCP2) вследствие, например, мутации в соответствующем гене, приводит к развитию синдрома Ретта у человека; инактивация метилцитозин-связывающего доменного белка 2 (Methyl-CpG binding domain protein 2 — MBD2), который участвует в репрессии транскрипции гиперметилированных генов, отмечена при онкологических заболеваниях.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №12
Тема урока: Метилирование ДНК у человека
Цель урока: развивать и углублять знания по теме метилирование ДНК у человека
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: У человека за процесс метилирования ДНК отвечают три фермента, называемые ДНК-метилтрансферазами 1, 3a и 3b (DNMT1, DNMT3a, DNMT3b), соответственно. Предполагается, что DNMT3a и DNMT3b — это de novo метилтрансферазы, которые осуществляют формирование паттерна метилирования ДНК на ранних стадиях развития, а также его изменения в процессе дифференцировки клеток. Существует гипотеза о том, что метилирование ДНК de novo вызывается, в частности,интерферирующими РНК при помощи РНК-зависимого метилирования ДНК — процесса, возникшего в ходе эволюции с целью репрессии мобильных элементов генома. DNMT1 является ДНК-метилтрансферазой, которая поддерживает метилированное состояние ДНК, присоединяя метильные группы к одной из цепей ДНК в точках, где другая, комплементарная ей цепь, метилирована. Предполагается, что роль ингибиторов ДНК метилазы DNMT1 регулирующих метилирование ДНК выполняют не-полиаденилированные длинные некодирующие РНК (lncRNA) Белок DNMT3L гомологичен другим DNMT-белкам, но не имеет каталитической активности. Вместо этого, DNMT3L поддерживает de novo метилтрансферазы, способствуя связыванию этих ферментов с ДНК и стимулируя их активность.
Важными этапами в развитии злокачественных новообразований является предварительное гипометилирование ДНКи последующая инактивация генов-супрессоров опухолевого роста[11]. В случае, когда инактивация была обусловлена метилированием промоторной области гена, проводились эксперименты по возобновлению экспрессии путём ингибирования DNMT. 5-aza-2'-дезоксицитидин (децитабин) является нуклеозидным аналогом, ингибирующим DNMT метилтрансферазы. Механизм действия препарата основан на ковалентном связывании фермента в комплексе с ДНК, что делает невозможным выполнение ферментом своей функции и приводит к деградации метилтрансферазы. Однако для того, чтобы децитабин был активен, он должен встроиться в геном клетки, но это, в свою очередь, может вызвать мутации в дочерних клетках, если клетка не погибает и продолжает деление. К тому же, децитабин токсичен для костного мозга, что сужает область его терапевтического применения. Эти ограничения привели к интенсивному поиску методов терапевтического воздействия, основанных на использовании «антисмысловых» РНК, которые противодействуют DNMT посредством деградации её мРНК и, следовательно, блокируют трансляцию. Возможность осуществить избирательно деметилирование гена и таким образом изменить его экспрессию дает открытие, так называемой, экстракодирующей РНК (extracoding RNA), которая способна связываться с DNMT1, блокируя его способность осуществлять метилирование конкретного гена. Тем не менее, по-прежнему остаётся открытым вопрос о том, является ли ингибирование функции DNMT1 достаточным условием для увеличения экспрессии генов-супрессоров, негативная регуляция транскрипции которых осуществляется метилированием ДНК.
Анализ персональных транскриптомов и метилломов человека показал, что корреляция между метилированием и экспрессией генов наблюдается только у менее 20% генов
Янг с соавт. разработали эффективный метод избирательного целевого деметилирования конкретных CpG в клетках человека с использованием объединенного путем молекулярной инженерии избирательно связывающего ДНК домена TALE (transcription activator-like effector) и каталитического домена TET1 гидроксилазы катализирующего превращение 5-метилцитозина в 5-гидроксиметилцитозин. Используя эту объединенную молекулу TALE-TET1, они показали, что деметилирование определенных CpG промотора может привести к существенному увеличению экспрессии соответствующих генов человека.
Разработана среда, которая вызывает гипометилирование ДНК в клетках in vitro. Эта среда, называемая 2i, содержит два низкомолекулярных ингибитора, один из которых ингибирует сигнальный путь ERK1 / 2, а другой Gsk3β. Она широко используется для перепрограммирования и поддержания плюрипотентного состояния клеток.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №13
Тема урока: Роль метилирования в онкогенезе
Цель урока: развивать и углублять знания по теме метилирования в онкогенезе
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Эпигенетический возраст, как выяснилось, влияет на вероятность заболеть раком. Был разработан алгоритм для вычисления эпигенетического возраста по данным метилирования ДНК крови. Алгоритм основывается на 71 маркере метилирования ДНК, которые могут меняться в зависимости от окружающей человека среды, физических упражнений и диеты. Исследование с помощью этого алгоритма коллекции образцов крови собранных за 15 лет, показало что те, у кого эпигенетический возраст примерно на один год старше их хронологического возраста имеют на 6% больший риск заболеть раком в течение трех лет, а те, кто примерно на 2,2 года старше своего хронологического возраста имеют на 17% повышенный риск смерти от рака в течение пяти лет
Сопоставление данных по генотипу людей, предрасположенных к онкологическим заболеваниям, с профилем метилирования их ДНК позволило предположить, что примерно в 20% случаев наследуемого рака обнаруживается взаимосвязь между уровнем метилирования определенных локусов и полиморфизмами генов, связанных с риском заболевания раком. В частности, наблюдалась высоко значимая корреляция между уровнем метилирования CpG и экспрессией ключевых генов рака, таких как MYC, TERT, and TP63
Около трети всех солидных опухолей связано с мутацией гена KRAS или же с мутациями в путях связанных KRAS. KRAS, выключает фермент TET1 который способствует инактивации генов путем метилирования. TET1 катализирует начальную стадию активного железо и альфа-кетоглутарат зависимого деметилирования ДНК у млекопитающих - превращение 5-метилцитозина (5-MC) в 5-гидроксиметилцитозин (5-HMC) окислением 5-MC. Добавление в эти мутантные клетки TET1 активизирует гены-супрессоры опухоли что, как оказалось, достаточно, чтобы уменьшить аномальную пролиферацию. Вместе с тем достаточно инактивировать TET1, чтобы сделать эти клетки снова злокачественными, даже без KRAS
Важным биомаркером онкогенеза является гиперметилирование CpG островков внутри промотора гена ZNF154 (zinc-finger protein 154) Гиперметилирование ZNF154 наблюдалось у подавляющего большинства опухолевых клеток, но отсутствовало в нормальных клетках. Какую функцию в организме выполняет ген ZNF154 пока не ясно. Одновременно обычно наблюдается гипометилирование в двух геномных областях, связанных с Casp8 (каспаза-8) и VHL (супрессор опухолей Гиппеля-Линдау
Метилирование ДНК у насекомых
Уровень метилирования ДНК у излюбленного объекта генетиков Drosophila melanogaster очень низкий, что мешало исследованию его методами бисульфитного секвенирования. Такаяма с соавт. разработали высокочувствительный метод, который позволил обнаружить, что профиль метилирования последовательностей ДНК генома мухи очень сильно отличается от профиля метилирования генома человека, животных или растений. Метилирование генома у дрозофилы сосредоточено в определённых коротких последовательностях оснований (из 5 пар нуклеотидов), которые богаты CA и CT, но обеднены гуанином. Кроме того оно, как оказалось, не зависит от DNMT2 активности. Дальнейшее изучение метилирования ДНК у дрозофилы поможет выявлению возрастных изменений эпигенома.
Метилирование ДНК у растений
В последнее время произошел значительный прорыв в понимании процесса метилирования ДНК у растений, особенно у Arabidopsis thaliana. Основными метилтрансферазами ДНК у A. thaliana являются Met1, Cmt3 и Drm2, которые на уровне аминокислотной последовательности подобны вышеописанным метилтранферазам ДНК у млекопитающих. Drm2, предположительно, участвует как в de-novo метилировании ДНК, так и в поддержании метилирования на более поздних стадиях развития. Cmt3 и Met1, главным образом, выполняют функцию поддержания метилирования ДНК. Прочие метилтрансферазы ДНК также присутствуют у растений, но их функция пока не выяснена Считается, что специфичность метилтрансферазы в процессе метилирования ДНК модулируется при помощи РНК. Специфичные РНК-транскрипты транскрибируются с определенных участков матрицы — геномной ДНК. Эти РНК-транскрипты могут формировать двухцепочные молекулы РНК. Двухцепочные РНК, посредством регуляторных сигнальных путей, связанных либо с малыми интерферирующими РНК (siRNA), либо смикроРНК (miRNA), детерминируют локализацию метилтрансфераз ДНК на участках специфических нуклеотидных последовательностей в геном.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №14
Тема урока: Репликация повреждений ДНК
Цель урока: развивать и углублять знания по темерепликация повреждений ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Разнообразные повреждения ДНК могут возникать спонтанно либо под действием внешних факторов. Клетки нуждаются в высокоэффективных способах репарации, поскольку
целостность ДНК существенна для выживания клетки и ее нормального функционирования, а
повреждения возникают постоянно. ДНК, содержащая приблизительно 3х109 пар оснований (у
человека) и 2х1011 ковалентных связей, представляет собой огромную мишень для
различного рода повреждающих факторов. Исходя из известной энергии связей, можно
подсчитать, что ДНК типичной клетки каждый день претерпевает спонтанно около 10 000
депуринизаций (потеря А или G оснований), 500 депиримидинизаций (потеря С или Т
оснований) и 160 дезаминирований цитидина (превращение С в Т).
Основным типом экзогенных повреждений ДНК является димеризация пиримидиновых
оснований. Это происходит под влиянием ультрафиолетового света в эпидермисе и приводит
к образованию тимидиновых димеров (связанных циклобутановым кольцом) или тимидин-
цитидиновых димеров. Такие повреждения репарируются к исходным основаниям путем
фотореактивации с помощью фермента фотолиазы, использующего в качестве кофактора
реакции видимый свет. Кроме того, такие повреждения могут устраняться тем же способом,
что и объемные аддукты (описывается далее). Ряд экзогенных факторов приводит к
образованию ДНК-аддуктов, которые подразделяются на малые и объемные. Малые повреждения
включают метилирование и этилирование, вызываемые, например, нитрозоаминами (DEN) и
нитрозоамидами (MNNG), как обсуждалось ранее. Обычно сайт для такой модификации – это
О6-позиция гуанина и О4-позиция тимина. Эти атомы кислорода обычно находятся в кето-
конфигурации для правильного спаривания оснований. Однако этилирование фиксирует эти
атомы в енольной конфигурации, таким образом, дестабилизируя обычное углеродное
связывание между основаниями в противоположных цепях, что часто приводит к
возникновению точечной мутации. Эти аддукты могут быть удалены белком, первоначально
идентифицированном как метилтрансфераза. В каталитическом центре фермента имеется
остаток цистеина, на который переносится алкильная группа (метильная более часто, чем
этильная) с О6- и О4- Т. Впервые этот фермент был обнаружен у бактерий, где он
участвовал в метилировании ДНК. Обработка бактерий малыми дозами MNNG может защищать
их при последующих введениях больших доз, которые иначе могут оказаться летальными.
Такой метод репарации является «дорогим», поскольку фермент необратимо инактивируется
переносом алкильной группы. Таким образом, клетке необходимо затратить много энергии на
создание нового белка при удалении каждого аддукта таким способом. Алкилирующие
соединения также могут формировать аддукты с фосфатным остовом. Поскольку
образовавшиеся фосфотриэфиры являются нестабильными, может произойти гидролиз одной из
трех фосфо-кислородных связей. Если разрывается связь с дезоксирибозой, то это приводит
к разрыву последовательности. Если разрывы в каждой из цепей расположены рядом, то
это может привести к разрыву хромосомы. Пути снижения дестабилизирующего эффекта
алкилирующих соединений на хромосомы включают транспозицию, обмен сестринскими
хроматидами, разрушение или измельчение хромосом.
Механизм действия алкилирующих соединений
Рис. 1. Механизм действия алкилирующихсоединений
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №15
Тема урока: Повреждение оснований
Цель урока:развивать и углублять знания по теме повреждение оснований
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Полициклические ароматические углеводороды, гетероциклические амины, афлатоксины и
ряд других соединений могут формировать объемные аддукты, которые не удаляются простой
реакцией переноса. N2- и N7-позиции гуанина являются особенно чувствительными к атаке
электрофильного углевода таких соединений, а ионы нитрониума из аминов обычно атакуют
С8-позицию гуанина. В обоих случаях формирование C-N-связи предпочтительно. Независимо
от позиции, такой аддукт сильно нарушает комплементарное спаривание оснований между
цепями и, следовательно, нарушает спиральную структуру ДНК, причем эти искажения
узнаются аппаратом репарации. Удаление объемных аддуктов путем вырезания начинается с
внесения эндонуклеазного разрыва в той же самой цепи рядом с аддуктом. Затем с помощью
экзонуклеазной активности, удаляется 15-20 оснований, включая поврежденное, после чего
пробел застраивается ДНК-полимеразой и лигируется для удаления разрыва. С другой
стороны, поврежденное основание может удаляться репарирующей гликозилазой. Как и в
случае спонтанной депуринизации, утерянное основание узнается как структурное нарушение
и репарируется путем вырезания. Существует несколько типов аддуктов, которые не
удаляются так легко. Во-первых, кислородные радикалы могут приводить к связыванию
клеточных белков с ДНК. Например, ионизирующее излучение (включая космические лучи)
производят гидроксил-радикалы, которые ковалентно связывают белки друг с другом и с
ДНК. Полагают, что ряд металлов, таких как никель и хром, могут восстанавливаться
внутри клетки. В ходе этих процессов могут вырабатываться высоко реакционноспособные
разновидности кислорода, которые повреждают мембраны, белки и ДНК. Модифицированные
основания ДНК могут быть использованы в качестве маркеров окислительных процессов в
клетке или окислительного стресса. Второй тип трудно репарируемых ДНК-аддуктов – это
образование поперечных сшивок между цепями ДНК, так называемые «кросслинки».
Бифункциональные агенты, которые вызывают такие нарушения, используются в
химиотерапии рака, например, циклофосфамиды. Опасность этого типа повреждений состоит
не только в разрушении нормальных водородных связей, но и в том, что затрудняется
отделение двух цепей ДНК в ходе репликации. Другой класс соединений, вызывающих
поперечные сшивки, представляет псорален и его производные, которые используются для
экспериментального лечения псориаза. В целом, под действием таких соединений возможны
как внутрицепочечные, так и межцепочечные поперечные сшивки.
Кроме точечных мутаций, могут иметь место хромосомные сшивки, разрывы и сдвиг
рамки считывания. Различные химические соединения, типа бромистого этидия (который
используется для визуализации ДНК в ходе гель-электрофореза) и акридина, встраиваются
между основаниями и искажают двойную цепь. Во время репликации происходят ошибки в
работе полимеразного комплекса, приводящие к вставке или делеции оснований. Если такая
ошибка произошла в кодирующей области для какого-либо белка, происходит мутация со
сдвигом рамки, т. е. изменяется рамка трансляции и считывание всех аминокислот,
кодируемых после сайта мутации. В целом, последствия таких мутаций более серьезны, чем
последствия точечных мутаций. Замена единственной аминокислоты может быть критична, но
чаще всего нет. Кроме того, приблизительно 1/3 точечных мутаций (обычно в третьей
позиции кодона) не приводит к аминокислотной замене. Однако сдвиг рамки может привести
к замене большого числа аминокислот, часто приводящей к денатурации или преждевременной
терминации белковой цепи.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №16
Тема урока: Преждевременная терминация белковой цепи
Цель урока:развивать и углублять знания по теме преждевременная терминация белковой цепи
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема
Повреждения ДНК имеют разнообразные вредные последствия. Клетки,
находящиеся в состоянии покоя, имеют больше шансов на репарацию повреждений и,
следовательно, могут избегать серьезных трудностей. Если геном не может быть
репарирован, клетки могут быть уничтожены, когда войдут в стадию репликации.
Инактивация генов, кодирующих определенные «критические» белки, может предотвратить
репликацию, совместно или нет со смертью клетки, снизить скорость клеточного роста,
изменить выживаемость. Однако, в редких случаях рост клетки, напротив, стимулируется.
За последние 50 лет стало известно, что повреждения ДНК ассоциированы с неоплазией.
Известно, что хромосомные транслокации и даже отдельные точечные мутации способны
привести к активации онкогена, а инактивация генов раковых супрессоров дает возможности неконтролируемого клеточного роста. Поэтому для анализа потенциальных канцерогенов
разрабатываются специальные тесты, с помощью которых оцениваются повреждения ДНК. Несмотря на это, защитные пути, существующие в клетках человека, не
воспроизводятся полностью в этом тесте. Когда тест Эймса впервые был разработан и
популяризован, 90% соединений, дающих позитивную реакцию в этом тесте, оценивалось как канцерогены для животных. По настоящим оценкам эта цифра составляет приблизительно 60% (соответствие между крысиными и мышиными канцерогенами оценивается как приблизительно 70%). Несмотря на это, тест привлекателен из-за его низкой стоимости и быстроты выполнения. Некоторые исследователи предполагают, что более точно предсказать канцерогенность соединения можно с использованием нескольких краткосрочных тестов.
Например, подразумевается, что соединение является потенциальным мутагеном, если оно
дает положительный ответ на бактериях, клетках дрозофилы и животных, а также вызывает
высокий уровень обмена между сестринскими хроматидами. Интересно, что увеличение
количества тестов лишь незначительно улучшает результаты самого по себе теста Эймса.
Ранние обзоры по мутагенности с привлечением теста Эймса и последовательный анализ с
использованием различных технологий показали, что мы действительно окружены мутагенами: многие продукты (пережаренное мясо) и другие продукты потребления (краски для волос), ультрафиолетовый свет, радон в болотном газе, космические лучи, количество которых удваивается при авиа перелетах на большой высоте. Таким образом, сохранение нашего здоровья напрямую зависит от эффективности процессов репарации ДНК. К сожалению, для индивидуумов, дефицитных по некоторым ферментам, важность репарации еще более усиливается. Например, при синдроме пигментации ксеродермы (Хeroderma pigmentosium syndrome) репарация повреждений от ультрафиолета нарушается. Такие люди вынуждены избегать солнечного света, у них с высокой частотой развивается рак кожи. Согласно последним исследованиям репарация настолько важна, что некоторые ее пути являются встроенными в процесс репликации.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №17
Тема урока: Строение и функции хромосом
Цель: развивать и углублять знания по теместроение и функции хромосом
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.Организационный момент: проверка готовности учащихся к уроку
Новая
тема:
Хромосомы — структуры клетки,
хранящие и передающие наследственную информацию. Хромосома состоит
из ДНК и белка. Комплекс белков, связанных с ДНК, образует
хроматин. Белки играют важную роль в упаковке молекул ДНК в
ядре.ДНК в хромосомах упакована таким образом, что умещается в
ядре, диаметр которого обычно не превышает 5 мкм
(5-10- 4 см). Упаковка ДНК
приобретает вид петельной структуры, похожей на хромосомы
типаламповых щеток амфибий или политенных хромосом насекомых. Петли
поддерживаются с помощью белков, которые узнают определенные
последовательности нуклеотидов и сближают их. Строение хромосомы
лучше всего видно в метафазе митоза.Хромосома представляет собой
палочковидную структуру и состоит из двух сестринских хроматид,
которые удерживаются центромерой в области первичной перетяжки.
Каждая хроматид а построена из хроматиновых петель. Хроматин не
реплицируется. Реплицируется только ДНК.
Рис. 1. Строение и репликация хромосомы
С началом репликации ДНК синтез РНК прекращается. Хромосомы могут находиться в двух состояниях: конденсированном (неактивном) и деконденсированном (активном).Диплоидный набор хромосом организма называют ка-риотипом. Современные методы исследования позволяют определить каждую хромосому в кариотипе. Для этого учитывают распределение видимых под микроскопом светлых и темных полос (чередование AT и ГЦ-пар) в хромосомах, обработанных специальными красителями. Поперечной исчер-ченностью обладают хромосомы представителей разных видов. У родственных видов, например у человека и шимпанзе, очень сходный характер чередования полос в хромосомах. Каждый вид организмов обладает постоянным числом, формой и составом хромосом. В кариотипе человека 46 хромосом — 44 аутосомы и 2 половые хромосомы. Мужчины ге-терогаметны (ХУ), а женщины гомогаметны (XX). У-хромосо-ма отличается от Х-хромосомы отсутствием некоторых аллелей (например, аллеля свертываемости крови). Хромосомы одной пары называют гомологичными. Гомологичные хромосомы в одинаковых локусах несут аллельные гены.
Морфология хромосом лучше всего видна в клетке на стадии метафазы.
Хромосома состоит из двух палочкообразных телец - хроматид. Обе
хроматиды каждой хромосомы идентичны друг другу по генному составу.
Хромосомы дифференцированы по длине. Хромосомы имеют центромеру или
первичную перетяжку, две теломеры и два плеча. На некоторых
хромосомах выделяют вторичные перетяжки и спутники. Движение
хромосомы определяет Центромера, которая имеет сложное
строение.
ДНК центромеры отличается характерной последовательностью
нуклеотидов и специфическими белками. В зависимости от расположения
центромеры различают акроцентрические, субметацентрические и
метацентрические хромосомы.
Как говорилось выше, некоторые хромосомы имеют вторичные перетяжки.
Они, в отличие от первичной перетяжки (центромеры), не служат
местом прикрепления нитей веретена и не играют никакой роли в
движении хромосом. Некоторые вторичные перетяжки связаны с
образованием ядрышек, в этом случае их называют ядрышковыми
организаторами. В ядрышковых организаторах расположены гены,
ответственные за синтез РНК. Функция других вторичных перетяжек еще
не ясна. У некоторых акроцентрических хромосом есть спутники —
участки, соединенные с остальной частью хромосомы тонкой нитью
хроматина. Форма и размеры спутника постоянны для данной хромосомы.
У человека спутники имеются у пяти пар хромосом. Концевые участки
хромосом, богатые структурным гетерохроматином, называются
теломерами. Теломеры препятствуют слипанию концов хромосом после
редупликации и тем самым способствуют сохранению их целостности.
Следовательно, теломеры ответственны за существование хромосом как
индивидуальных образований.
Хромосомы, имеющие одинаковый порядок генов, называют
гомологичными. Они имеют одинаковое строение (длина, расположение
центромеры и т. д.). Негомологичные хромосомы имеют разный генный
набор и разное строение.

Исследование тонкой структуры хромосом
показало, что они состоят из ДНК, белка и небольшого количества
РНК. Молекула ДНК несет отрицательные заряды, распределенные по
всей длине, а присоединенные к ней белки — гистоны заряжены
положительно. Этот комплекс ДНК с белком называют хроматином.
Хроматин может иметь разную степень конденсации. Конденсированный
хроматин называют гетерохроматином, деконденсированный хроматин —
эухроматином. Степень деконденсации хроматина отражает его
функциональное состояние. Гетерохроматиновые участки функционально
менее активны, чем эухроматиновые, в которых локализована большая
часть генов. Различают структурный гетерохроматин, количество,
которого различается в разных хромосомах, но располагается он
постоянно в околоцентромерных районах. Кроме структурного
гетерохроматина существует факультативный гетерохроматин, который
появляется в хромосоме при сверхспирализации эухроматических
районов. Подтверждением существования этого явления в хромосомах
человека служит факт генетической инактивации одной Х-хромосомы в
соматических клетках женщины. Его суть заключается в том, что
существует эволюционно сформировавшийся механизм инактивации второй
дозы генов, локализованных в Х-хромосоме, вследствие чего, несмотря
на разное число Х-хромосом в мужском и женском организмах, число
функционирующих в них генов уравнено. Максимально конденсирован
хроматин во время митотического деления клеток, тогда его можно
обнаружить в виде плотных хромосом
Размеры молекул ДНК хромосом огромны. Каждая хромосома представлена
одной молекулой ДНК. Они могут достигать сотен микрометров и даже
сантиметров. Из хромосом человека самая большая — первая; ее ДНК
имеет общую длину до 7 см. Суммарная длина молекул ДНК всех
хромосом одной клетки человека составляет 170 см.
Несмотря на гигантские размеры молекул ДНК, она достаточно плотно
упакована в хромосомах. Такую специфическую укладку хромосомной ДНК
обеспечивают белки гистоны. Гистоны располагаются по длине молекулы
ДНК в виде блоков. В один блок входит 8 молекул гистонов, образуя
нуклеосому (образование, состоящее из нити ДНК, намотанной вокруг
октамера гистонов). Размер нуклеосомы около 10 нм. Нуклеосомы имеют
вид нанизанных на нитку бусинок. Нуклеосомы и соединяющие их
участки ДНК плотно упакованы в виде спирали, на каждый виток такой
спирали приходится шесть нуклеосом. Так формируется структура
хромосомы. Наследственная информация организма строго упорядочена
по отдельным хромосомам. Каждый организм характеризуется
определенным набором хромосом (число, размеры и структура), который
называется кариотипом. Кариотип человека представлен двадцатью
четырьмя разными хромосомами (22 пары аутосом, Х- и Y-хромосомы).
Кариотип — это паспорт вида. Анализ кариотипа позволяет выявлять
нарушения, которые могут приводить к аномалиям развития,
наследственным болезням или гибели плодов и эмбрионов на ранних
стадиях развития.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №18
Тема урока: Организация генетического материала
Цель урока:развивать и углублять знания по темеорганизация генетического материала
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
-
Код триплетен. В состав РНК входят 4 нуклеотида: А, Г, Ц, У. Если бы мы пытались обозначить одну аминокислоту одним нуклеотидом, то 16 из 20 аминокислот остались бы не зашифрованы. Двухбуквенный код позволил бы зашифровать 16 аминокислот (из четырех нуклеотидов можно составить 16 различных комбинаций, в каждой из которых имеется два нуклеотида) . Природа создала трехбуквенный, или триплетный, код. Это означает, что каждая из 20 аминокислот зашифрована последовательностью трех нуклеотидов, называемых триплетом или кодоном. Из 4 нуклеотидов можно создать 64 различные комбинации по 3 нуклеотида в каждой (4*4*4=64). Этого с избытком хватает для кодирования 20 аминокислот и, казалось бы, 44 кодона являются лишними. Однако это не так.
2. Код вырожден. Это означает, что каждая аминокислота шифруется более чем одним кодоном (от двух до шести) . Исключение составляют аминокислоты метионин и триптофан, каждая из которых кодируется только одним триплетом. Тот факт, что метионин кодируется одним триплетом АУТ, имеет особый смысл, который вам станет понятен позже.
3. Код однозначен. Каждый кодон шифрует только одну аминокислоту. У всех здоровых людей в гене, несущем информацию о бета-цепи гемоглобина, триплет ГАА или ГАГ, стоящий на шестом месте, кодирует глутаминовую кислоту. У больных серповидноклеточной анемией второй нуклеотид в этом триплете заменен на У. Как видно из таблицы, триплеты ГУА или ГУГ, которые в этом случае образуются, кодируют аминокислоту валин. К чему приводит такая замена, вы уже знаете из раздела о ДНК .
4. Между генами имеются "знаки препинания". В печатном тексте в конце каждой фразы стоит точка. Несколько связанных по смыслу фраз составляют абзац. На языке генетической информации таким абзацем являются оперон и комплементарная ему и-РНК. Каждый ген в опероне кодирует одну полипептидную цепочку - фразу. Так как в ряде случаев по матрице и-РНК последовательно создается несколько разных полипептидных цепей, они должны быть отделены друг от друга. Для этого в генетическом коде существуют три специальные триплета - УАА, УАГ, УГА, каждый из которых обозначает прекрдщение синтеза одной полипептидной цепи. Таким образом, эти триплеты выполняют функцию знаков препинания. Они находятся в конце каждого гена. Внутри гена нет "знаков препинания". Поскольку генетический код подобен языку, разберем это свойство на примере такой составленной из триплетов фразы: жил был кот тих был сер мил мне тот кот. Смысл написанного понятен, несмотря на отсутствие "знаков препинания. Если же мы уберем в первом слове одну букву (один нуклеотид в гене) , но читать будем также тройками букв, то получится бессмыслица: илб ылк отт ихб ылс ерм илм нет отк от Нарушение смысла возникает и при выпадении одного или двух нуклеотидов из гена. Белок, который будет считываться с такого испорченного гена, не будет иметь ничего общего с тем белком, который кодировался нормальным геном.
5. Код универсален. Генетический код един для всех живущих на Земле существ. У бактерий и грибов, пшеницы и хлопка, рыб и червей, лягушки и человека одни и те же триплеты кодируют одни и те же аминокислоты..
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №19
Тема урока: Способ записи генетической информации в молекуле ДНК. Биологический код и его свойства
Цель урока:развивать и углублять знания по темес пособ записи генетической информации в молекуле ДНК. Биологический код и его свойства
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Первично все многообразие жизни обусловливается разнообразием белковых молекул, выполняющих в клетках различные биологические функции. Структура белков определяется набором и порядком расположения аминокислот в их пептидных цепях. Именно эта последовательность аминокислот в пептидах зашифрована в молекулах ДНК с помощью биологического (генетического) кода. Относительная примитивность структуры ДНК, представляющей чередование всего лишь четырех различных нуклеотидов, долгое время мешала исследователям рассматривать это соединение как материальный субстрат наследственности и изменчивости, в котором должна быть зашифрована чрезвычайно разнообразная информация.
В 1954 г. Г. Гамовым было высказано предположение, что кодирование информации в молекулах ДНК должно осуществляться сочетаниями нескольких нуклеотидов. В многообразии белков, существующих в природе, было обнаружено около 20 различных аминокислот. Для шифровки такого их числа достаточное количество сочетаний нуклеотидов может обеспечить лишь триплетный код, в котором каждая аминокислота шифруется тремя стоящими рядом нуклеотидами. В этом случае из четырех нуклеотидов образуется 43 = 64 триплета. Код, состоящий из двух нуклеотидов, дал бы возможность зашифровать только 42 = 16 различных аминокислот.
Полная расшифовка генетического кода проведена в 60-х гг. нашего столетия. Из 64 возможных триплетов ДНК 61 кодирует различные аминокислоты; оставшиеся 3 получили название бессмысленных, или «нонсенс-триплетов». Они не шифруют аминокислот и выполняют функцию знаков препинания при считывании наследственной информации. К ним относятся АТТ, АЦТ, АТЦ.
Обращает на себя внимание явная избыточность кода, проявляющаяся в том, что многие аминокислоты шифруются несколькими триплетамию. Это свойство триплетного кода, названное вырожденностью, имеет очень важное значение, так как возникновение в структуре молекулы ДНК изменений по типу замены одного нукле-отида в полинуклеотидной цепи может не изменить смысла триплета. Возникшее таким образом новое сочетание из трех нуклеотидов кодирует ту же самую аминокислоту.
В процессе изучения свойств генетического кода была обнаружена его специфичность. Каждый триплет способен кодировать только одну определенную аминокислоту. Интересным фактом является полное соответствие кода у различных видов живых организмов. Такая универсальность генетического кода свидетельствует о единстве происхождения всего многообразия живых форм на Земле в процессе биологической эволюции.
Незначительные отличия генетического кода обнаружены в ДНК митохондрий некоторых видов. Это не противоречит в целом положению об универсальности кода, но свидетельствует в пользу определенной дивергентности в его эволюции на ранних этапах существования жизни. Расшифровка кода в ДНК митохондрий различных видов показала, что во всех случаях в митохондриальных ДНК отмечается общая особенность: триплет АЦТ читается как АЦЦ, и поэтому из нонсенс-триплета превращается в шифр аминокислоты триптофана.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №20
Тема урока: Оперонная организация генетического материала у бактерий.
Цель урока:развивать и углублять знания по темеоперонная организация генетического материала бактерий
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Компонент промоторов у кишечной палочки — так называемый бокс (последовательность) Прибнова:в) Что касается участков связывания регуляторных белков, то у бактерий их называют операторами. Они располагаются после промотора (рис.1). При определенных условиях с оператором связывается специфический белок-репрессор, и это блокирует «прочтение» РНК-полимеразой соответствующей группы генов. У эукариот регуляцию «прочтения» генов осуществляют не только белки-репрессоры, но и белки-активаторы — т. н. транскрипционные факторы (рис.1).

Рис. 1. Функциональные отделы в ДНК бактерий
К последним относятся уже упоминавшиеся общие факторы транскрипции, необходимые для связывания РНК-полимеразы с промотором. Эти факторы имеются во всех клетках и необходимы для «прочтения» любого функционирующего гена. Другие транскрипционные факторы повышают активность только определенных генов, и локусы ДНК, связывающие такие факторы, называются энхансерами. Энхансеры могут располагаться достаточно далеко от регулируемого гена: на расстоянии нескольких тысяч нуклеотидных пар. Как же связывание с ними транскрипционных факторов может стимулировать активность гена?Видимо, дело в сложной пространственной организации ДНК. Последняя образует петли, благодаря чему энхансеры сближаются с промоторной зоной и связанные с ними факторы влияют на активность транскрипционного комплекса (рис.2).

Рис.2. Функциональные отделы в ДНК эукариот
Причем, для некоторых ключевых генов в клетке имеется сразу несколько энхансеров, достаточно удаленных друг от друга. Следовательно, все они в результате изгибов ДНК должны собираться примерно в одном месте пространства.
Что же касается белков-репрессоров, то они при вхождении в состав транскрипционных комплексов не повышают, а понижают их активность.
Часто используется также термин «супрессоры» — так называются факторы (обычно это белки), которые угнетают тот или иной клеточный процесс. Например, опухолевые супрессоры — регуляторные белки, препятствующие опухолевому росту. Очевидно, по механизму своего действия они могут быть как репрессорами, так и транскрипционными факторами.
г) В ДНК могут содержаться короткие локусы, служащие сигналами об окончании (терминации) транскрипции ДНК.
У бактерий в ряде случаев участки с такой функцией находятся перед группой совместно регулируемых генов. Это т. н. аттенюаторы (см. рис.1). Терминирующие же участки, располагающиеся после генов, называются терминаторами.
В одних условиях транскрипция прекращается на аттенюаторе (гены не считываются), в других условиях — на терминаторе (гены прочитываются).
У эукариот сигналы терминации более сложные: в отличие от бактериальных, они тоже транскрибируются РНК-полимеразой, и только затем последняя завершает свою работу.
У бактерий гены ферментов, катализирующих ряд последовательных реакций, нередко объединяются в одну структурно-функциональную единицу — оперон (рис.3).

Рис.3. Схема функционирования оперона
Помимо указанных генов, в оперон входят промотор (место связывания РНК-полимеразы) и оператор (место связывания белка-репрессора).Сам же белок-репрессор кодируется специальным геном-регулятором, который в состав оперона обычно не входит. Для разных оперонов существуют разные белки-репрессоры и, соответственно, разные гены-регуляторы. Хотя не исключено, что какие-то белки-репрессоры контролируют активность сразу нескольких оперонов.Принцип регуляции активности оперона состоит в том, что на сродство белка-репрессора к оператору могут влиять метаболиты той цепи реакций, ферменты которой кодируются данным опероном. В связи с этим различают опероны двух типов.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №21
Тема урока: Конститутивные гены и белки
Цель урока:развивать и углублять знания по темеконститутивные гены и белки
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Подобным образом регулируется активность далеко не всех генов.
Многие гены являются конститутивными, т. е. все время находятся в активном состоянии, и скорость их транскрипции не подвергается избирательной регуляции (хотя и может меняться в связи с изменением общего состояния клетки). Такие гены кодируют белки (в т. ч. ферменты), постоянно необходимые клетке.Эти белки (как и гены) тоже называются конститутивными. Для кишечной палочки к подобным белкам относятся, например, ферменты метаболизма глюкозы.Но скорость транскрипции различных конститутивных генов может не совпадать. Этому может быть несколько причин.
а) Одна из них — различное сродство промоторов к РНК-полиме-разе, или, как говорят, различная «сила» промоторов.
У некоторых конститутивных генов промотор имеет высокое сродство к РНК-полимеразе (т. е. является «сильным»). Поэтому здесь молекулы РНК-полимеразы связываются с промотором часто, отчего за единицу времени образуется большое количество копий мРНК.
У промоторов других генов невысокое сродство к РНК-полимеразе. Соответственно, молекулы этого фермента связываются редко, и образуется гораздо меньше копий мРНК.
б) Вторая возможная причина заключается в самой РНК-полимеразе.В разных условиях существования бактериальной клетки образуются сигма-факторы, узнающие разные промоторы. Так, особые сигма-факторы соответствуют обычным условиям, азотному голоданию, тепловому шоку и состоянию споруляции. В каждом из этих случаев РНК-полимераза связывается с промоторами одних генов и не связывается с промоторами других генов.
Таким образом, у бактерий используются два принципиальных способа регуляции экспрессии генов:
- регуляция связывания РНК-полимеразы с промоторами (за счет природы промотора, природы сигма-фактора РНК-полимеразы, а также, как мы увидим на примере лактозного оперона, специального белка САР);
- регуляция перемещения связавшейся РНК-полимеразы от промотора к собственно генам (при «чисто» опероном механизме регуляции).Лактозный оперон интересен тем, что здесь в одной регуляторной системе используются сразу оба только что названных принципиальных подхода — регуляция и связывания РНК-полимеразы, и ее перемещения через оператор.Причем, существуют и другие опероны со сходным принципом организации. Примечательно, что все они являются индуцибельными и все контролируют распад (катаболизм) поступающих извне питательных веществ. В то же время не для всех таких веществ имеется оперонный принцип регуляции, примером чему, как отмечалось выше, служит глюкоза.
Рассмортим лактозный оперон (рис.1).

Рис.1. Схема лактозного оперона
Пр- промотор, О – оператор, С- САР (белковый активатор катаболизма), Е- РНК-полимераза, Rл – репрессор лактозного оперона, Е1- b-галактозидаза, Е2- пермеаза, Е3- трансацетилаза, АЦ- аденилатциклаза
Он включает три гена. Из них первые два кодируют ферменты утилизации лактозы: пермеазу и b-галактозидазу.
Пермеаза необходима для проникновения лактозы из внешней среды в клетку. Заметим, что даже при «выключенном» опероне имеется небольшое количество пермеазы. Поэтому при появлении во внешней среде лактозы какое-то количество ее может проникать внутрь и оказывать сигнальное воздействие на лактозный оперон.
Второй фермент — b-галактозидаза — катализирует распад лактозы на глюкозу и галактозу. Последние далее вступают в катаболические превращения, обеспечиваемые конститутивными ферментами. При «выключенном» опероне имеется небольшая активность и этого фермента. Это важно потому, что параллельно с основной реакцией (гидролизом лактозы) происходит и побочная — изомеризация лактозы в аллолактозу (где галактоза и глюкоза соединены не 1,4-, а 1,6-гликозидной связью). И именно аллолактоза, а не лактоза, служит регулятором активности оперона.
Конкретно, аллолактоза, появляясь в клетке при наличии во внешней среде лактозы, связывается с лактозным репрессором. Этот белок кодируется специальным геном, имеет 4 субъединицы и в отсутствие аллолактозы связывается с оператором лактозного оперона, блокируя транскрипцию генов оперона. Аллолактоза же, связываясь с репрессором, снижает его сродство к оператору, что деблокирует гены. Таким образом, при появлении вне клетки лактозы происходит активация лактозного оперона и интенсивное образование в клетке ферментов утилизации лактозы.
Но это имеет место только тогда, когда во внешней среде нет глюкозы. Если же там достаточно глюкозы, то биологического смысла в использовании лактозы уже нет. В соответствии с этим, глюкоза препятствует активации лактозного оперона даже в присутствии больших количеств лактозы.
Достигается это путем влияния на связывание РНК-полимеразы с промотором. Дело в том, что промоторная область в лактозном опероне (и в сходных с ним оперонах) шире, чем обычно, и способна связывать не только РНК-полимеразу, но и особый белок — CAP (catabolite gene activator protein), белковый активатор катаболизма.В отсутствие САР РНК-полимераза очень плохо связывается с промотором лактозного оперона, а САР изменяет структуру промотора, резко повышая его сродство к РНК-полимеразе. По существу, САР играет у бактерий примерно ту же роль, что общие факторы транскрипции у эукариот. Только САР необходим для деятельности лишь некоторых оперонов, тогда как общие факторы транскрипции — для функционирования любого гена эукариот.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №22
Тема урока: Количественные особенности генома эукариот
Цель урока:развивать и углублять знания по темеколичественные особенности генома эукариот
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Главная количественная особенность генетического материала эукариот наличие избыточной ДНК. Этот факт легко выявляется при анализе отношения числа генов к количеству ДНК в геноме бактерий и млекопитающих.
Нуклеотидные последовательности в геноме эукариот
В конце 60-х годов работами американских ученых Р. Бриттена, Э. Дэвидсона и других была открыта фундаментальная особенность молекулярной структуры генома эукариот - нуклеотидные последовательности разной степени повторяемости. Это открытие было сделано с помощью молекулярно-биологического метода изучения кинетики ренатурации денатурированной ДНК. Различают следующие фракции в геноме эукариот.Уникальные, т.е. последовательности, представ-ленные в одном экземпляре или немногими копиями. Как правило, это цистроны структурные гены, кодирующие белки. Низкочастотные повторы последовательности, повторяющиеся десятки раз.
Промежуточные, или среднечастотные, повторы - последовательности, повторяющиеся сотни и тысячи раз. К ним относятся гены рРНК (у человека 200 на гаплоидный набор, у мыши - 100, у кошки - 1000, у рыб и цветковых растений - тысячи), тРНК, гены рибосомных белков и белков-гистонов.
Высокочастотные повторы, число которых достигает 10 миллионов (на геном). Это короткие (~ 10 пн) некодирующие последовательности, которые входят в состав прицентромерного гетерохроматина.ДНК мышей на 70% состоит из уникальных последовательностей, на 20% - из низкочастотных и среднечастотных повторов, на 10% - из высокочастотных.Повторы образуют так называемые семейства, под которыми понимают совокупность последовательностей, полностью или по большей части гомологичных друг другу.
Нередко из-за существенных различий в нуклеотидном составе высокочастотных повторов и остальной ДНК первые образуют при центрифугировании в градиенте плотности хлористого цезия так называемые сателлитные пики, которые имеют большую или меньшую плавучую плотность, чем остальная ДНК. Эта фракция генома пред-ставлена небольшим (10…15) числом семейств коротких (5…12 п.н.) повторов, образующих протяженные блоки. Внутри блоков группы повторов отдельных семейств могут чередоваться друг с другом, так что сателлитная ДНК имеет как бы лоскутную структуру. Гибридизация фракций высокочастотных последовательностей с ДНК непосредственно на препаратах хромосом позволила установить, что эта фракция генома локализована в районах конститутивного гетерохроматина, чаще всего прицентромерного или теломерного. Еще в 30-х годах было показано, что в генетическом отношении эти районы инертны, т. е. не содержат генов. В действительности столь малые после-довательности, составляющие сателлитную ДНК, не могут кодировать ничего, кроме олигопептидов. Более того, гетерохроматические районы не транскрибируются. Таким образом, в случае высокочастотных последовательностей ДНК обнаруживается тождество молекулярной организации и генетических свойств хромосомной ДНК эукариот. Следует отметить, что эта фракция у огромного большинства видов занимает не более 10% генома. Близкие виды, например мышь и крыса, имеют совершенно различ-ные высокочастотные последовательности, у крысы их нуклеотидный состав не отличается от основной ДНК, тогда как геном мыши содержит четкий АТ-богатый сател-лит. Это означает, что высокочастотная ДНК способна к быстрым изменениям в ходе видообразования.
Остальные 90 % генома эукариот, его эухроматическая часть, построены по принципу чередования (интерсперсии) уникальных и повторяющихся последовательностей. Условно выделяют два основных типа интерсперсии, полу-чивших названия по тем видам, у которых они впервые были описаны: интерсперсия типа «ксенопус» (обнару-жена у шпорцевой лягушки Xenopus laevis) и типа «дрозофила» (впервые описана у плодовой мушки D. melanogaster). Примерно в 50 % генома Xenopus laevis уникальные последовательности из 800…1200 п.н. чередуются с повторяющимися, средний размер которых 300 п.н. В остальной части геномов типа «ксенопус» расстояния между соседними повторами значительно превышают 1…2 п.н. Структура генома типа «ксенопус» широко распространена, особенно среди жи-вотных. Млекопитающие и человек также относятся к этому типу организации генома. Особенность генома человека и других приматов составляют интерсперсные высокоча-стотные повторы длиной около 300 п.н. У человека эти повторы содержат сайт, разрезаемый ферментом рестрик-ции Alu I. Число Alu-подобных повторов в геноме человека достигает 5?105, а по некоторым данным, даже 106.
Alu-подобные последовательности приматов представ-ляют собой частичные дупликации (удвоения) последо-вательности В1 в геноме грызунов, впервые описанной Г. П. Георгиевым и его сотрудниками.У D. melanogaster параметры интерсперсии резко от-личаются от видов с типом генома «ксенопус»: повторяю-щиеся последовательности длиной 5600 п.н. чередуются с уникальными, длина которых не менее 13000 п.н. Инте-ресно отметить, что у домашней мухи геном устроен по типу «ксенопус». Этот факт прямо указывает на то, что в ходе эволюции возможны очень быстрые преобразования характера чередования последовательностей и в эухроматической части генома. Птицы по параметрам интерс-персии занимают промежуточное положение между типом «ксенопус» и типом «дрозофила». Как показывают резуль-таты исследований последних лет, многие виды животных и растений по организации генома не могут быть строго отнесены ни к тому, ни к другому типу. Так, в геномах мле-копитающих встречаются длинные повторы - в несколько тысяч пар нуклеотидов, в геномах лилейных до 90% ДНК может быть представлено повторяющимися последова-тельностями. Например, геном гороха не содержит уни-кальных последовательностей, превышающих по длине 300 п.н.
Другая особенность повторяющихся последовательно-стей в геномах эукариот - инвертированные повторы, или палиндромы (см. ниже). В условиях ренатурации они практически мгновенно формируют дуплексные структуры. По существу, палиндромы представляют собой часть про-межуточных повторов. Однако некоторые высокочастот-ные повторы в эухроматической части генома, например члены Alu-семейств, могут встречаться как в прямом, так и в инвертированном положении. Иногда между инвер-тированными повторами вклиниваются другие последо-вательности.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №23
Тема урока: Конститутивные гены и белки.
Цель урока:развивать и углублять знания по теме конститутивные гены и белки
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
У эукариот описаны некоторые особенности структуры ДНК, обусловленные спецификой нуклеотидного состава отдельных последовательностей. Так, встречаются расположенные в одной цепи блоки нуклеотидов, состоящих из нескольких десятков пуринов. Тогда комплементарная часть в другой цепи ДНК будет представлена пиримидинами. Подобные последовательности названы полипуриновыми (полипиримидиновыми) блоками.
Другой вид гетерогенности связан с неравномерностью содержания по длине ДНК пар аденин-тимин (АТпары) и гуанин-цитозин (ГЦ-пары). Так, в геноме дрозофилы периодически встречаются последовательности длиной примерно в 100 п. н., на 85 % состоящие из АТпар. По скольку аденин связан с тимином двумя водородными связями, а гуанин с цитозином тремя, дестабилизи-рующие ДНКвоздействия будут легче инициировать расплетание дуплексов ДНК с образованием участков частич-ной денатурации в АТ-богатых областях. По-этому последние рассматриваются в качестве сайтов ини-циации элементарных генетических процессов: реплика-ции, транскрипции и рекомбинации.
В заключение отметим, что перечисленные выше осо-бенности молекулярной структуры ДНК эукариот не были предсказаны ни классической генетикой (за исключением, пожалуй, свойств гетерохроматина), ни моделью двойной спирали Уотсона и Крика. Они были раскрыты при иссле-довании структуры геномов различных эукариотических организмов физико-химическими методами. Функции большинства повторяющихся и уникальных последова-тельностей пока не определены. Однако вполне вероятно, что сама по себе молекулярная структура ДНК эукариот служит зеркалом генетической регуляции и эволюции выс-ших животных и растений.
Хроматин и компактизация хромосом
Основой генетического аппарата эукариот являются линейные хромосомы. В основе хромосомы лежит линейная двуспиральная правозакрученная молекула ДНК, связанная со специфическими белками-гистонами. Известно 5 типов гистонов: Н1, Н2А, Н2В, НЗ, Н4. В ядрах эритроцитов птиц Н1 частично замещается на Н5. У дрожжей отсутствует Н1, а у некоторых видов хламидомонад гистоны вообще не обнаружены. Гистоны отсутствуют также у мезокариот (одноклеточных организмов - динофлагеллят, ночесветок), в сперматозоидах некоторых рыб. Отсутствие гистонов в перечисленных случаях рассматривается как вторичное явление. Гистоны Н2 - Н4 эволюционно устойчивы: из 102 аминокислот Н4 наблюдаются различия лишь по 1-2 аминокислотам у высших растений, рыб и млекопитающих. Гистон Н1 весьма вариабелен, и даже в тканях одного организма встречается 3 - 6 вариантов этого белка.
Гистоны Н2 - Н4 образуют белковое ядро из 8 полипептидов (каждый гистон повторяется 2 раза). Вокруг этого ядра уложен участок ДНК длиной 140 пн, образующий 1,75 витка по периферии. Такая структура называется нуклеосома. Отдельные нуклеосомы это дисковидные частицы диаметром около 10 нм. Закручивание ДНК вокруг нуклеосомы уменьшает ее длину в семь раз. Участки ДНК между нуклеосомами длиной 15…10 пн называются линкерами (связками). Структура линкеров стабилизируется с помощью гистона Н1.
Последовательность нуклеосом образует или еще одну спираль диаметром 25…20 нм (соленоид), или последовательность нуклеосомных группировок нуклеомеров. Эти высшие структуры образуют петли или домены. Кон-денсация ДНК в структуре соленоида дополнительно (к нуклеосомному уровню) уменьшает ее длину в шесть раз. В интерфазных хромосомах путем еще одного цикла конденсации соленоиды образуют полые трубочки диаметром 200 нм, что уменьшает длину ДНК еще в 18 раз.
Описанная структура хромосом у эукариот обеспечивает их устойчивость и недоступность основной массы ДНК для химических мутагенов. При транскрипции, т.е. синтезе РНК, и репликации происходит деспирализация хромосом, что обеспечивает возможность контакта определенных участков ДНК с ДНКполимеразой или РНК-полимеразой.
Определенные участки хромосом в ядре тесно связаны с ядерной мембраной. Всегда связаны с мембраной концевые (теломерные) участки и некоторые другие (интерстициальные) участки. Такие связи обеспечивают определенную структуру ядра и защищают хромосомы от разрушения ферментами нуклеазами. Ю. С. Ченцовым и его сотрудниками открыта специальная частица, обес-печивающая связь хроматина с ядерной мембраной, которую предложено называть анкоросомой (якорной частицей).
В метафазе вследствие дальнейшей конденсации возникает большая образованная дезоксинуклеопротеидом спираль диаметром около 600 нм. В результате строго упорядоченной иерархии спиралей, в основе которой лежит нуклеосома, в митозе и мейозе хромосомы эукариот совершают цикл компактизации декомпактизации.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №24
Тема урока: Особенности репликации эукариотических хромосом
Цель урока:развивать и углублять знания по тема особенности репликации эукариотических хромосом
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Особенности репликации эукариотических хромосом
Как и у прокариот, репликация ДНК в клетках эукарио-тических организмов осуществляется полуконсервативно, о чем свидетельствует распределение Нитимидиновой метки по сестринским хроматидам во втором и последующих митозах после инкубации клеток с радиоактив-ными предшественниками. Выяснено, что репликация у эукариот носит двунаправленный характер.
Принцип регуляции репликации ДНК эукариот в онтогенезе был открыт английским цитогенетиком Г. Кэлланом в 1972 г. С помощью радиоавтографии меченных 3Н-тимидином волокон ДНК, полученных из клеток животных непосредственно на предметном стекле, Кэллан определил скорость репликации и расстояние между сосед-ними центрами инициации в S-фазе соматических и эмбриональных клеток.
По первому показателю между этими типами клеток больших различий не наблюдалось. Число сайтов инициа-ции репликации было максимальным в раннем эмбриогенезе, минимальным в предмейотической S-фазе и промежуточным в соматических клетках. Эти данные в принципе были подтверждены позднее прямым электронномикроскопическим анализом реплицирующейся ДНК из дробщихся яиц дрозофилы. Таким образом, суть регуляции процесса репликации у эукариот заключается в измене-нии числа сайтов инициации репликации. Этот механизм позволяет увеличить продолжительность фазы S (а, сле-довательно, всего митотического цикла) с 3,5 мин (на ран-них стадиях дробления яиц дрозофилы) до десятков часов в предмейотической S-фазе. Упаковка ДНК и гистонов в нуклеосомы происходит в фазе S, поскольку гистоны синтезируются синхронно с репликацией ДНК.
Переключение генов у эукариот У эукариот опероны отсутствуют, и система управления активностью генов более сложная. Во-первых, у эукариот включаются не три гена (или чуть больше), а целые батареи генов. Во-вторых, регуляция активности генов происходит не за счет связывания оператора с белком репрессором, а за счет спирализации и деспирализации хромосом. В третьих, у эукариот регуляция работы генов происходит не по принципу «да-нет», а по принципу «больше меньше».
У прокариот регуляторные участки составляют примерно 5 % от всей ДНК, а у эукариот длина регуляторных участков соизмерима с общей длиной структурных генов. Регуляторные белки у эукариот влияют не только на работу генов в одной хромосоме, но и на активность функционально сходных генов в разных хромосомах. Например, - и -цепи гемоглобина кодируются генами, расположенными в разных хромосомах. Однако количество -цепей равно количеству -цепей. Промоторы и операторы у эукариот могут быть удалены от структурных генов на значительное расстояние.
У многоклеточных эукариот в ходе онтогенеза из исходной клетки развивается целостный организм. На разных этапах онтогенеза в разных тканях с разной интенсивностью экспрессируются разные гены. Активность генов у эукариот регулируется разнообразными эндо- и экзогенными факторами, в том числе, и гормонами. Способность исходной клетки реализовывать генетическую информацию в ходе клеточных делений и дифференцировки клеток называется тотипотентностью. У растений тотипотентны и оплодотворенные яйцеклетки, и почти все соматические клетки. У животных тотипотентна только зигота (а также некоторые клетки низших беспозвоночных). Поэтому методы клонирования животных основаны на пересадке ядер из соматических клеток в энуклеированные яйцеклетки (то есть яйцеклетки с убитым ядром).
Выключение генов может быть обратимым и необратимым. У животных существует два типа дробления зиготы: недетерминированное (дифференцировка клеток на поздних стадиях онтогенеза) и детерминированное (дифференцировка клеток на самых ранних этапах дробления зиготы). В первом случае можно пересадить ядро из клеток кишечного эпителия головастика в яйцеклетку с убитым с помощью ультрафиолетового облучения ядром. Из такой синтезированной клетки разовьется нормальная лягушка. Во втором случае клетки передней части бластодермы дрозофилы способны формировать только структуры передней части тела имаго, а клетки задней части бластодермы - только структуры задней части тела.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №25
Тема урока: Структура РНК
Цель урока:развивать и углублять знания
по теместруктура РНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нук-леотиды связаны между собой 3',5'-фосфодиэфирными связями. Концы полинуклеотидных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа 5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гидролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется.
Вторичная структура РНК
Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК.
Третичная структура РНК
Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удалёнными друг от друга, или связей между ОН-группами остатков рибозы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями.
Основные типы РНКВ цитоплазме клеток присутствуют 3 типа рибонуклеиновых кислот - транспортные РНК (тРНК), матричные РНК (мРНК) и рибосомальные РНК (рРНК). Они различаются по первичной структуре, молекулярной массе, конфор-мации, продолжительности жизни и, самое главное, по функциональной активности.
Транспортные РНК (тРНК)
Пространственную структуру любых тРНК, независимо от различий в последовательности нук-леотидов, описывают универсальной моделью "клеверного листа". В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним, в частности, относят участок, ответственный за связывание с аминокислотой на 3'-конце молекулы и антикодон - специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК.
В состав нуклеотидов тРНК входят минорные основания (в среднем 10-12 оснований на молекулу). Они представлены метилированными основаниями, изомерами и аналогами пиримидинов.
Минорные основания выполняют 2 функции: они делают тРНК устойчивыми к действию нук-леаз цитоплазмы и поддерживают определённую третичную структуру молекулы, так как не могут участвовать в образовании комплементарных

Рис. 1. Строение транспортных РНК.
Спирализованные участки обозначены на рисунке пунктиром; "общие участки" одинаковы у всех тРНК; 1 - петля переменного размера; UH2 (дигидроурацил), ψ (псевдоурацил) - минорные основания; антикодону всегда предшествует U (урацил), а после него всегда стоит минорное основание пар, и препятствуют спирализации определённых участков в полинуклеотидной последовательности тРНК.
Матричные РНК (мРНК)
Первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5'- и З'-концов. Так, на 5'- конце присутствует модифицированный нуклеотид 7-метилгуанозин-5'-трифосфат (кэп). Несколько десятков нуклеотидов отделяют кэп от инициирующего кодона, обычно это триплет -AUG-. За кодирующим участком следует один из терминирующих кодонов -UGA-, -UUA-, -UAG-. На 3'-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмонофосфатных остатков.
Рибосомальные РНК (рРНК)
Рибосомальные РНК имеют многочисленные спирализованные участки. Различают рРНК - 5S, 5,8S, 28S и 18S (S - коэффициент седиментации). Рибосомальные РНК содержат несколько

Рис. 2. Минорные основания тРНК.
модифицированных нуклеотидов, чаще всего это метилированные производные азотистых оснований или рибозы (2'-метилрибоза). рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №26
Тема урока: Синтез РНК.
Цель урока:развивать и углублять знания по темесинтез РНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: При включении гена
сначала происходит локальное расплетение ДНК и синтезируется
РНК-копия генетической программы. В результате сложных обработок ее
специальными белками получается матричная РНК (мРНК), которая и
является программой для синтеза белка. Эта РНК переносится из ядра
в цитоплазму клетки, где она связывается со специальными клеточными
структурами — рибосомами, настоящими молекулярными «машинами» для
синтеза белка. Белок синтезируется из активированных аминокислот,
присоединенных к особым транспортным РНК (т:РНК), причем каждая из
аминокислот присоединена к своей специфической тРНК. Благодаря тРНК
аминокислота фиксируется в каталитическом центре рибосомы, где она
«пришивается» к синтезируемой белковой цепи. Из рассмотренной
последовательности событий видно, что молекулы РНК играют ключевую
роль в декодировании генетической информации и биосинтезе
белка.
Чем больше углублялись в изучение различных биосинтетических
процессов, тем чаще обнаруживали ранее неизвестные функции РНК.
Оказалось, что кроме процесса транскрипции (синтеза РНК путем
копирования участка ДНК) в ряде случаев, наоборот, может
происходить синтез ДНК на РНК-матрицах. Этот процесс, названный
обратной транскрипцией, используют в ходе своего развития многие
вирусы, в том числе печально известные онкогенные вирусы и ВИЧ-1,
вызывающий СПИД.
Таким образом, выяснилось, что поток генетической информации не
является, как первоначально считалось, однонаправленным — от ДНК к
РНК. Роль ДНК как изначально главного носителя генетической
информации стала подвергаться сомнению. Тем более что многие вирусы
(гриппа, клещевого энцефалита и другие) вообще не используют ДНК в
качестве генетического материала, их геном построен исключительно
из РНК. А далее посыпались одно за другим открытия, которые
заставили совершенно по-другому взглянуть на РНК.
Все гены РНК делят на 3 группы – кодирует и-РНК, (Синтез белка – на них строится и-РНК), кодирует р-РНК, кодирует т-РНК.. У прокариот известно 7 генов, кодирующих р-РНК. Длина каждого такого гена около 5 тыс. нуклеотид. На таком гене сначала образ-ся незрелая р-РНК. В ней содержатся: несущие информацию ставки, информация о 3 видах р-РНК и о нескольких видах т-РНК. Созревание состоит в том, что вырезаются все ставки и цепи р- и т-РНК. Основная часть генов т-РНК одиночная. Часть т-РНК генов объединится в группы с генами р-РНК.
Транскрипция (от лат. transcriptio — переписывание) — процесс
синтеза РНК с использованием ДНК в качестве матрицы, происходящий
во всех живых клетках. Другими словами, это перенос генетической
информации с ДНК на РНК. Транскрипция катализируется ферментом
ДНК-зависимой РНК-полимеразой.
Инициация транскрипции — сложный процесс, зависящий от
последовательности ДНК вблизи транскрибируемой последовательности
(а у эукариот также и от более далеких участков генома — энхансеров
и сайленсеров) и от наличия или отсутствия различных белковых
факторов.
Момент перехода РНК-полимеразы от инициации транскрипции к
элонгации точно не определен. Три основных биохимических события
характеризуют этот переход в случае РНК-полимеразы кишечной
палочки: отделение сигма-фактора, первая транслокация молекулы
фермента вдоль матрицы и сильная стабилизация транскрипционного
комплекса, который кроме РНК-полимеразы включает растущую цепь РНК
и транскрибируемую ДНК. Эти же явления характерны и для
РНК-полимераз эукариот. Переход от инициации к элонгации
сопровождается разрывом связей между ферментом, промотором,
факторами инициации транскрипции, а в ряде случаев — переходом
РНК-полимеразы в состояние компетентности в отношении элонгации
(например, фосфорилирование CTD-домена у РНК-полимеразы II). Фаза
элонгации заканчивается после освобождения растущего транскрипта и
диссоциации фермента от матрицы (терминация).
На стадии элонгации в ДНК расплетено примерно 18 пар нуклеотидов.
Примерно 12 нуклеотидов матричной нити ДНК образует гибридную
спираль с растущим концом цепи РНК. По мере движения РНК-полимеразы
по матрице впереди нее происходит расплетание, а позади —
восстановление двойной спирали ДНК. Одновременно освобождается
очередное звено растущей цепи РНК из комплекса с матрицей и
РНК-полимеразой. Эти перемещения должны сопровождаться
относительным вращением РНК-полимеразы и ДНК. Трудно себе
представить, как это может происходить в клетке, особенно при
транскрипции хроматина. Поэтому не исключено, что для
предотвращения такого вращения двигающуюся по ДНК РНК-полимеразу
сопровождают топоизомеразы.
Элонгация осуществляется с помощью основных элонгирующих факторов,
необходимых, чтобы процесс не останавливался преждевременно. В
последнее время появились данные, показывающие, что регуляторные
факторы также могут регулировать элонгацию. РНК-полимераза в
процессе элонгации делает паузы на определенных участках гена.
Особенно четко это видно при низких концентрациях субстратов. В
некоторых участках матрицы длительные задержки в продвижении
РНК-полимеразы, т. н. паузы, наблюдаются даже при оптимальных
концентрациях субстратов. Продолжительность этих пауз может
контролироваться факторами элонгации.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №27
Тема урока Синтез ДНК
Цель урока:развивать и углублять знания по темесинтез ДНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Репликация ДНК – процесс самоудвоения ДНК. Происходит в S – период интерфазы. Репликация всех двуцепочечных ДНК поликонсервативна, т.е. в дочерней молекуле одна цепь родительская, а другая построена вновь. Репликация начинается в особых точках молекулы ДНК – точках инициации синтеза или точках ori. У прокариот на единственной молекуле ДНК имеется одна точка ori. У эукариот на одной молекуле ДНК (число молекул ДНК = числу хромосом) множество точек ori, расположенных на расстоянии 20000 пар нуклеотидов др. от друга. Материнская молекула ДНК начинает расходиться на 2 цепи в точке ori с образованием вилки репликации на материнской цепи (ориентированной 3'–5'). Дочерняя цепь строится из свободных дезоксинуклеотидов ядра сразу в направлении 5'-3'. И это строительство совпадает с удвоением вилки репликации, эта дочерняя цепь называется лидирующей. На материнской цепи ДНК, антипараллельно матричной, дочерняя цепь запаздывающая, она строится отдельными кусками или фрагментами – указаки, т.к. направление строительства противоположно движению вилки репликации. Для начала синтеза ДНК требуется прайнер – короткая РНК – затравка длиной 5-10 рибонуклеотидов. Прайнер связывает первый свободный дезоксинуклеотид и начинает строить дочерние цепи ДНК. В лидирующей цепи прайнер один, а в запаздывающей у каждого отрезка указаки – длина этих отрезков 100-200 нуклеотидов у высших организмов, 1000-2000 у прокариот.
При
синтезе макромолекул ДНК, РНК или белков один активный центр
фермента не в состоянии обеспечить специфическую последовательность
четырёх кодирующих единиц. Он может связывать между собой только
один или несколько «строительных блоков», а нуклеиновые кислоты
содержат в своём составе тысячи нуклеотидов. Поэтому природа пошла
здесь по другому пути: матрицей для синтеза цепи молекулы ДНК
служит другая цепь ДНК.
Транскрипция ДНК в ходе деления клеток начинается с разделения двух
цепей, каждая из которых становится матрицей, синтезирующей
нуклеотидную последовательность новых цепей. Хеликаза,
топоизомераза и ДНК-связывающие белки расплетают ДНК, удерживают
матрицу в разведённом состоянии и вращают молекулу ДНК.
Правильность репликации обеспечивается точным соответствием
комплементарных пар оснований. Репликация катализуется несколькими
ДНК-полимеразами, а транскрипция – ферментом РНК-полимеразой. После
репликации дочерние спирали закручиваются обратно уже без затрат
энергии и каких-либо ферментов.
Сравнительно неплохо изучен процесс репликации и транскрипции ДНК
бактерий. Их ДНК способна реплицироваться, не распрямляясь в
линейную молекулу, то есть в кольцевой форме. Процесс, по-видимому,
начинается на определённом участке кольца и идёт сразу в двух
направлениях (в одном – непрерывно, во втором – фрагментарно с
последующим «склеиванием» фрагментов). Инициация репликации
находится под контролем клеточной регуляции. Скорость репликации
ДНК составляет около 45 000 нуклеотидов в минуту; таким образом,
родительская вилка расплетается со скоростью 4500 об/мин.
Ферменты репликации: для синтеза прайнеров нужна РНК – полимераза. для образования эфирных связей между фосфатами дезоксинуклеотидов при строительстве цепи ДНК нужна ДНК полимеразы. Для вырезания прайнеров, неправильно включённых в состав ДНК нуклеотидов, нужна ДНК – экзонуклеаза. Для сшивания фрагментов указаки в сплошную запаздывающую дочернюю цепь нужен фермент ДНГ – лигаза. Скорость синтеза ДНК у эукариот 10-100 пар нуклеотидов в секунду, а у прокариот 1500 пар (в одном месте). Репликация по типу катящегося колеса. Двухцепочечная кольцевая ДНК надрезается в точке начала катящегося кольца. Причём надрезается одна цепь из двух – матричная. К освободившемуся 3' концу этой цепи начинают пристраиваться свободные дезоксинуклеотиды. По мере удлинения дочерней цепи ДНК 5' конец из материнского кольца вытесняется. Когда 3' и 5' концы встретятся в одной точке, синтез ДНК прекращается и дочернее кольцо отделяется от материнского.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №28
Тема урока: Созревание РНК
Цель урока:развивать и углублять знания по темесозревание РНК
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Во многих генах высших организмов последовательности нуклеотидов, кодирующие аминокислоты, чередуются с некодирующими. Кодирующие последовательности называются экзонами, а некодирующие После переписывания наследственной информации из ДНК в РНК получается «сырой продукт» — молекула РНК, в которой также вперемежку расположены экзоны и интроны. Чтобы с такой РНК была считана правильная аминокислотная последовательность, из неё необходимо «вырезать» всё ненужное, т. е. интроны, а оставшиеся экзоны «склеить» друг с другом. Иными словами, РНК нуждается в дальнейшей обработке или, как говорят биохимики, созревании. Так и происходит на самом деле. В клетках высших организмов «сырая» РНК разрезается на более короткие кусочки, а потом некоторые из них склеиваются между собой.
В большинстве случаев в процессе разрезания-склеивания принимают участие целые молекулярные комплексы, состоящие из небольших молекул РНК и белков. Они играют роль ферментов, которые ускоряют и контролируют правильное протекание химических реакций, сопровождающих созревание матричной РНК. Но некоторые интроны вырезаются без всякой посторонней помощи. Учёные пришли к заключению, что в таких случаях интрон сам выступает в роли фермента, отвечающего за собственное удаление из РНК и склеивание двух обрамлявших его экзонов. Это совершенно потрясающее явление природы, поскольку ферментативную активность здесь проявляет не белок, а молекула РНК!
Помимо разрезания-склеивания молекулы РНК высших организмов претерпевают и другие химические изменения в ходе созревания. Только после такой обработки появляется «зрелая» матричная РНК, с которой может работать рибосома. По этой причине, в отличие от своих «коллег» в низших организмах, рибосомы эукариот не могут начать производство белков, пока не завершится переписывание из ДНК в РНК: они вынуждены ждать созревания матричной РНК.
Процесс формирования зрелых (то есть функционально активных)
молекул РНК из предшественников,
называемыйпроцессингом – важнейший этап
образования многих видов и-РНК. Все стабильные РНК бактерий
также синтезируются в виде первичных
транскриптов, из которых затем образуются
зрелые р-РНК или т-РНК. Аналогичным
путем происходит образование и
эукариотических р-РНК и т-РНК.
В отличие от эукариотических, большинство бактериальных и-РНК представляют собой первичные транскрипты, которые в состоянии непосредственно взаимодействовать с рибосомами, так что только в очень редких случаях их трансляции должен предшествовать процессинг.
У эукариот, напротив, образование зрелой и-РНК, кодируемойпрерывистым геном – наиболее сложный процесс из всех видов процессинга РНК, включающий большое число реакцийсплайсинга(вырезания), обеспечивающих соединениеэкзоновпутем удаления интронов.
Все реакции процессинга являются высокоспецифичными, что приводит к образованию зрелых молекул РНК с уникальными 5'- и 3'-концами. Реакции процессинга осуществляютсяспецифическими ферментами (рибонуклеазами), способными расщеплять фосфодиэфирные в молекулах РНК.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №29
Тема урока: Распад мРНК
|
Цель урока:развивать и углублять знания по темераспад мРНК Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся. Ход урока. Организационный момент: проверка готовности учащихся к уроку Новая тема: |
Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. Различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие деполимеризациюнуклеиновых кислот с образованием олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или олигонуклеотидов. Помимо гидролитическихнуклеаз, имеются ферменты, катализирующие распад нуклеиновых кислот, например, посредством трансферазной реакции. Они катализируют перенос остатка фосфорной кислоты от 5'-го углеродного атомарибозы одного мононуклеотида ко 2'-му углеродному атому соседнего мононуклеотида, сопровождающийся разрывом межнуклеотидной связи и образованием фосфодиэфирной связи между 2'-м и 3'-м углероднымиатомами рибозы одного и того же мононуклеотида. К настоящему времени открыты группы нуклеаз, катализирующие распад ДНК и РНК.
Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфир-ных связей в одной из двух цепеймолекулы ДНК между 3'-м углеродным атомом дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов:
ДНК + (n–1) Н2O –> n-Олигодезоксирибонуклеотиды.
Среди продуктов реакции открыты также моно- и динуклеотиды. Типичными представителями этихферментов являются ДНКазы поджелудочной железы. Одна из них (ДНКаза I) была получена в чистом виде, расшифрована последовательность всех ее 257 аминокислотных остатков. Фермент наиболее активен при рН 6,8–8,0, активируется двухвалентными ионами Mg2+и Мn2+ и ингибируется конечными продуктами ферментативной реакции – олигонуклеотидами.
Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Представителем их является ДНКаза II, выделенная из селезенки, имеющая мол. массу 38000 и состоящая из 343 аминокислотных остатков. В составе этой ДНКазы открыт глюкозамин. Фермент также активируетсяионами металлов, ингибируется анионами; его оптимум рН между 5,5 и 5,8.
Помимо этих ферментов, открыты (преимущественно у микроорганизмов) еще экзодезоксирибонуклеазы, гидролизующие фосфодиэфирные связи молекулы ДНК с отщеплением концевых 5'-дезоксирибонуклеотидов. Например, из E. coli выделено четыре таких фермента, обозначаемых экзодезоксирибонуклеазами I, II, III и IV.
Рестриктазы – ферменты ДНКазного типа действия – катализируют распад чужеродной (в основном фаговой)ДНК в строго определенных участках молекулы, имеющих структуру палиндромов. Из E. coli выделены и охарактеризованы две такие рестриктазы, обозначаемые EcoRI и EcoRII соответственно. Рестриктазыоказывают строго специфическое действие, поэтому они используются для расшифровки последовательности нуклео-тидных остатков в ДНК фагов и вирусов. Кроме того, это уникальное свойстворестриктаз находит все большее практическое применение в генетической инженерии при «вырезании» определенных фрагментов ДНК и «встраивании» их в геном бактериальной ДНК (получение рекомби-нантных ДНК). В результате клетке передается ряд не свойственных ей прежде наследственных признаков. Теоретическое и главным образом практическое значение подобных исследований трудно переоценить. Свидетельством огромного интереса к проблемам генетической инженерии является создание и успешное выполнение в институтах Российской АН и лабораторий ряда стран совместной комплексной программы – проекта «Рестриктазы».
Многие сотни рестриктаз выделены в очищенном состоянии и уже являются коммерческими препаратами.Из ферментов, катализирующих гидролитический распад РНК, наиболее изучены рибонуклеазы I. Они гидролизуют фосфодиэфирные связи внутри молекулы РНК. Выделенная из поджелудочной железы многих животных РНКаза состоит из 124 аминокислотных остатков во всех случаях, хотя ферменты несколько различаются последовательностью аминокислотных остатков; выяснена также третичная структура рядаРНКаз (см. главу 4). Получен в гомогенном состоянии из плесневого гриба рода Aspergillus ферментгуанилрибонуклеаза, катализирующая эндонуклеолитическое расщепление РНК.
Из ферментов, осуществляющих распад ДНК и РНК не по гидролитическому пути, следует назвать полинуклеотид-фосфорилазу и группу ДНК-гликозидаз. В настоящее время подробно изучены физико-химические свойства и биологическая роль микробной полинуклеотид-фосфорилазы в лаборатории С.С. Дебова; в той же лаборатории фермент открыт в животных тканях.
Механизм действия фермента сводится к переносу нуклеотидных остатков с РНК на неорганический фосфат, при этом образуется рибо-нуклеотиддифосфат (РДФ):
![]()
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №30
Тема урока: Трансляция мРНК у эукариот
Цель урока: развивать и углублять знания по теметрансляция мРНК у эукариот.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Процесс трансляции эукариотической мРНК в основном аналогичен таковому прокариотической мРНК. За некоторыми отмеченными выше исключениями, генетический код универсален и кодоны последовательно транслируются с помощью специфических аминоацил-тРНК-синтетаз на рибосомах. Есть, однако, и три явных различия, обусловленных определенными свойствами эукариотических клеток. Во-первых, аппараты транскрипции и трансляции у эукариот физически разобщены, поскольку транскрипция осуществляется в ядре, а трансляция – в цитоплазме. Во-вторых, на 5'- и 3'-концах эукариотических мРНК имеются особые структуры. И в-третьих, эукариотические мРНК, за исключением мРНК, транскрибируемых с ДНК геномов вирусов, обычно содержат только одну белок-кодирующую последовательность.
Структура и свойства участников трансляции эукариотической мРНК пока изучены гораздо хуже, чем у прокариот. И хотя у эукариот выделяют те же три стадии процесса – инициацию, элонгацию и терминацию, – на каждой из них требуется больше нерибосомных белковых факторов. Несмотря на эти различия, последовательности, кодирующие белки прокариот, нормально транслируются эукариотическими системами трансляции при условии соответствующей модификации их мРНК на 3'- и 5'-концах. И наоборот, кодирующие последовательности эукариот эффективно транслируются системами прокариот, если у них перед 5'-концом инициаторного кодона AUG имеется последовательность Шайна-Дальгарно. Это значит, что трансляционные аппараты обоих типов организмов могут осуществлять свои функции, несмотря на особенности нуклеотидных последовательностей мРНК из разных источников.
а. Особые модификации мРНК эукариот
У эукариотических мРНК, транскрибированных с ядерных или вирусных геномов РНК-полимеразой II, всегда модифицированы 5'-концы, которые в этом случае называют «кэпами». РНК, транскрибируемые эукариотическими РНК-полимеразами I и III, не кэпированы и имеют обычные 5'-фосфатные концы. У большинства мРНК, синтезируемых РНК-содержащими вирусами животных, также имеются кэпы, хотя они синтезируются вирусными РНК-транскриптазами. Многие некэпированные мРНК неэффективно транслируются эукариотическими белоксинтезирующими системами из-за слабого связывания рибосом с мРНК. Кэпирование происходит на 5'-нуклеозидтрифосфате вскоре после инициации синтеза РНК-транскриптов и задолго до его завершения.
На 3'-концах эукариотических мРНК имеются еще и полиаденилатные последовательности. Такой 3' – «хвост» из 50–200 аденилатных остатков не кодируется смысловыми последовательностями соответствующих генов, а присоединяется посттранскрипционно, после разрезания транскрипта в специфическом месте за сигналом терминации трансляции.
б. Инициация трансляции на 5'-кэпированных концах малыми рибосомными субчастицами
Как мы уже говорили, обязательным этапом при инициации трансляции прокариотической мРНК является диссоциация 70S-рибосомы; точно так же и 80S-рибосомы должны диссоциировать до начала трансляции эукариотических мРНК. Малая субчастица в комплексе со множеством белков-помощников, из которых один или несколько нужны для диссоциации рибосомы на составляющие субчастицы, связывает особую инициаторную met-тPHK. И вновь для связывания инициаторной аминоацил-тРНК необходимы GTP и особый белок – eIF-2. У эукариот, однако, met-TPHK не подвергается N-формилированию; но, как и у прокариот, структура тРНК отличается от структуры тPHKMMet. Комплекс 40S, содержащий met-тPHKIMet, GTP и целую армию других факторов eIF, связывается с мРНК вблизи кэпированного 5'-конца или прямо с этим концом; по крайней мере один из этих факторов узнает кэп и связывается с ним. Малая субчастица перемещается при помощи неизвестного пока механизма от кэпированного конца до первого кодона AUG. Никакой последовательности вблизи кодона AUG, аналогичной последовательности Шайна-Дальгарно, пока не обнаружено. Однако эффективность работы AUG в качестве инициатор-ного кодона зависит от наличия определенных фланкирующих нуклеотидов. Такой преинициаторный комплекс объединяется с 60S-субчастицей в ходе энерго- и фактор-зависимой реакции с образованием функционального комплекса инициации. Инициация белкового синтеза может регулироваться фосфорилированием и дефосфорилированием eIF-2.
в. Элонгация и терминация полипептидной цепи
Поэтапная трансляция последовательных кодонов с помощью аминоацил-тРНК у эу- и прокариот в принципе сходна. GTP и фактор элонгации eEF-1, соответствующий прокариотическому комплексу EF-Tu и EF-Ts, периодически поставляют рибосомам аминоацил-тРНК. GTP и eEF-2, являющиеся функциональными аналогами прокариотического EF-G, осуществляют транслокацию. Терминация трансляции у эукариот также происходит в одном из трех стоп-кодонов и сопровождается отделением свободных полипептидных цепей, мРНК и, возможно, 80S-рибосом от мРНК. По-видимому, всю серию терминационных событий осуществляют один фактор eRF и GTP.
В результате последовательных актов инициации образуются полисомы и одновременно, как и у прокариот, начинается трансляция множества кодирующих белки последовательностей. Заметное отличие трансляции у эукариот состоит в том, что клеточные мРНК обычно содержат одну-единственную кодирующую последовательность. Если в мРНК имеется несколько таких областей, то последующие либо вовсе не транслируются, либо транслируются неэффективно
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №31
Трансляция мРНК у прокариот
Цель урока:развивать и углублять знания по теметрансляция мРНК у прокариот.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Зная всех участников процесса, мы можем теперь приступить к рассмотрению химических реакций, протекающих при синтезе полипептидов, т.е. реакций, участвующих в собственно трансляции. Несмотря на то, что этот процесс протекает непрерывно от старта к финишу, обычно выделяют три его этапа: инициацию, элонгацию и терминацию. Рассматривая каждый из этапов направляемого мРНК синтеза полипептидной цепи, мы должны учитывать два основных свойства этого процесса. Вопервых, полипептидные цепи синтезируются однонаправленно: с аминоконца к карбоксиконцу. При этом карбоксильная группа уже образовавшегося участка полипептидной цепи соединяется с аминогруппой следующей присоединяемой аминокислоты с помощью пептидной связи. Это может произойти, лишь если карбоксильный конец растущей полипептидной цепи находится в активированном состоянии. Как мы уже отмечали, необходимая для этого энергия поступает в результате присоединения карбоксильной группы растущей полипептидной цепи и каждой присоединяемой аминокислоты к тРНК. Во-вторых, считывание мРНК начинается с кодона AUG, который обозначает 5'-конец кодирующей последовательности и детерминирует N-концевую аминокислоту синтезируемого полипептида. При инициации первая и вторая молекулы аминоацил-тРНК спариваются с первыми двумя кодонами мРНК. Далее трансляция продолжается в направлении 5'–>3' кодон за кодоном до тех пор, пока не достигнет стоп-сигнала, расположенного сразу же за кодоном, детерминирующим С-концевую аминокислоту.
а. Условия инициации
70S-рибосома способна осуществлять трансляцию последовательности мРНК, но не может инициировать этот процесс. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы. 30S-субчастица в комплексе с IF-1 и IF-3 связывает IF-2, GTP и Fmet-тРНК. Такой полный комплекс связывается с 5'-концом кодирующей последовательности мРНК вблизи кодона AUG. Очевидно, IF-2 способен отличить Fmet-тРНК от тРНК, и эта специфичность отчасти обеспечивается N-формильной группой, отсутствующей у ТРНК Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S^6-частицы с преинициаторным комплексом. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Как узнается первый кодон? Связывание 30S-6-частицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно за 10 нуклеотидов до 5'-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами последовательности из пяти-восьми нуклеотидов, называемой последовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3'-конца 16S-pPHK. Эффективность инициации существенно зависит от степени комплементарности между последовательностями Шайна-Дальгарно и 16S-pPHK и от расстояния пурин-богатого участка до кодона AUG. Эта особенность наряду с другими, о которых будет сказано позднее, и объясняет различия в эффективности трансляции различных мРНК.
Процесс инициации зависит также от вторичной структуры того участка молекулы мРНК, в котором находится инициаторный кодон AUG. Если этот кодон окажется внутри двухцепочечного участка, то инициация будет неэффективна или вовсе блокируется. Именно таким образом может регулироваться доступность инициаторного AUG-кодона для 30S-рибосомы. AUG становится недоступным, если он оказывается спаренным при образовании конденсированной формы зрелой мРНК, и, напротив, доступным для инициации во время транскрипции мРНК или во время трансляции других кодирующих последовательностей на той же молекуле мРНК.
б. Элонгация полипептидной цепи
При ассоциации двух рибосомных субчастиц перед инициацией трансляции образуются два функциональных участка, необходимых для сборки белка: Р- и А-участки. Fmet-TPHKj» занимает Р-участок, а для образования первой пептидной связи необходимо, чтобы аминоацил-тРНК, соответствующая следующему кодону, заняла А-участок. Для этого аминоацил-тРНК должна сначала связать EF-Tu и GTP. Образовавшийся тройной комплекс и доставляет аминоацил-тРНК к А-участку. GTP в это время гидролизуется, и комплекс отделяется от рибосомы. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК, а в Р – свободная тРНК.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться. Однако, прежде чем это произойдет, тРНК должна освободить Р-участок, образовавшаяся дипептидил-тРНК должна переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы осуществляются с помощью EF-G при GTP-зависимой транслокации рибосомы. Источником энергии для перемещения рибосомы к следующему триплету кодирующей последовательности и удаления свободной тРНК из Р-сайта служит реакция гидролиза GTP до GDP. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
Урок №32
Тема урока: Фолдинг белка
Цель урока:развивать и углублять знания по темефолдинг белка.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема:
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
Переход первичной структуры полипептида (слева) в третичную структуру (справа).
Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность,гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура — конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостикимежду пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами. Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков (более подробно это описано в статье Прионы).
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его аминокислотной последовательности.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №33
Цель урока:развивать и углублять знания по темемодификация белка.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Модификацибелковэто(от позднелат. Modificatioизменение) биогенная, происходит послезавершения трансляции матричной рибонуклеиновой кислоты, или мРНК,(синтез белка на мРНКматрице) илидо ее завершения. В пер-вом случае Модификация белков называется п о с т т р а н с л я ц и о н н о й, во втором -к o т р а н c л я ц ио н н о й. Осуществляется благодаря р-циям разл. функц. групп аминокислотных остатков, а также пептидныхсвязей и обусловливает конечную форму белковой молекулы, ее физиол. активность, стабильность,перемещения внутри клетки.
Внеклеточные (секретируемые) белки, а также мн. белки цитоплазматич. мембраны и разл. Внутри-клеточныхкомпартментов (обособленных участков клетки) подвергаются гликозилированию, в результате которогообразуются гликопротеины. Наиболее сложно организованы маннозосодержащие цепи, присоединенные кполипептидам Nгликозидной связью. Начальная стадия формирования таких цепей протекаеткотрансляционно по схеме:
Dol-долихол (полипренол), DolЧРЧР-долихолпирофосфат, Glc-глюкоза, GlсNАс-N-ацетил-D-глюкозамин, Маn-манноза
Последующии стадии осуществляются посттрансляционно с участием неск. ферментов, локализованных в разныхсубклеточных компартментах. Так, для G-белка вируса везикулярного стоматита, гликозидные цепи к-рогопостроены из 15 углеводных остатков, установлена такая последовательность событий. Сначала вэндоплазматической ретикулуме происходит в две стадии отделение терминальных остатков глюкозы с участиемдвух разных глюкозидаз. Затем маннозидазы (I и II) удаляют 6 ос-татков маннозы, а N-ацетил-Dглюкозаминтрансфераза осуществляет присоединение трех остатков GlcNAc к остаткам маннозыгликопротеина. Наконец, в комплексе Гольджи с этими остатками связываются с участием соответствующихтрансфераз остатки фукозы, галактозы и сиаловой к-ты. Моносахаридные остатки могут подвергатьсяфосфорилированию, сульфированию и др. модификациям.
Гликозилированию секретируемых белков предшествует протеолитич. процессинг отделение от N-концаполи
пептидной цепи "сигнальной" последовательности аминокислот. В эукариотич. клетках (клетки всехорганизмов, за исключением бактерий и синезеленых водорослей) этот процесс осуществляетсяконтрансляционно, в прокариотических клетках (клетки бактерий и синезеленых водорослей) он может протекатьпосттрансляционно. Наиболее распространенные сигнальные последовательности включают 23 аминокислотных остатка. Характерные особенности этих последовательностей наличие на конце короткого положительнозаряженного участка, за которым следует гидрофобный участок, содержащий от 7 до 14 аминокислотныхостатков. Сигнальные последовательности завершаются консервативным по длине (5-7 остатков)гидрофильным участком, на конце которого чаще всего находятся остатки аланина, глицина, серина,треонина, цистeина или глутамина.
Почти все функцион. классы внеклеточных белков (ферменты, гормоны, иммуноглобулины и др.) содержатдисульфидные связи. Они образуются из групп SH цистенна в ходе многостадийного процесса с участиемфермента дисульфидизомеразы. На его ранних стадиях появляется значит. количество "неправильных"дисульфидных мостиков, которые ликвидируются в результате тиолдисульфидного обмена, в котором, повидимому, участвует цистамин (H2NCH2CH2S)2. Предполагают, что такой "перебор" связей происходит до техпор, пока не возникает наиб. стабильная третичная структура, в ко-торой дисульфидные мостики "захоронены" ивследствие этого недоступны реагентам.
К наиболее распространенным модификациям внутриклеточных белков относятся фосфорилированис идефосфорилирование по группе ОН остатков серина, тирозина и треонина, которые осуществляются с участием ферментов протеинкиназ и фосфатаз по схеме:

АТФ - аденозинтрифосфат, АДФ - аденозиндифосфат, Р -фосфорная к-та или ее остаток
Фосфорилирование сопровождается активацией или инактивацией ферментов, напр. гликозилтрансфераз, атакже изменением физ.-хим. св-в неферментных белков. Обратимое фосфорилирование белков контролирует, например, такие важные процессы, как транскрипция и трансляция, метаболизм липидов,глюконеогенез, мышечное сокращение.
Белки митохондрий и хлоропластов, кодируемые ядерными ДНК, имеют на N-конце избыточныеаминокислотные последовательности, которые избирательно направляют полипептидные цепи в определенныекомпартменты органелл, после чего отщепляются в результате протеолиза с участием специфич.эндопептидаз. Избыточные последовательности предшественников митохондриальных белков существенноразличаются по количеству аминокислотных остатков; их может быть от 22 до 80. Короткие последовательностихарактеризуются высоким (20-25%) содержанием положительно заряженных аминокислотных остатков,равномерно расположенных по полипептидной цепи. Длинные последовательности включают дополнительноучасток, сос-тоящий из гидрофобных аминокислот
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить презентацию по данной теме
Урок №34
Тема урока: Получение антибиотиков.
Цель урока:развивать и углублять знания по темеполучение антибиотиков.
Средства обучения: ИКТ (компьютер, проектор, экран, диск с презентацией), рабочая тетрадь учащихся.
Ход урока.
Организационный момент: проверка готовности учащихся к уроку
Новая тема: Способностью вырабатывать антибиотики обладают не все микроорганизмы, а лишь некоторые штаммы отдельных видов. Так пенициллин образуют некоторые штаммы Penicillium notatum и P. chrysogenum, астрептомицин определенный штамм Streptomyces griseus, тогда как другие штаммы тех же видов
либо вообще не вырабатывают антибиотики, либо вырабатывают, но другие. Существуют также различия междуштаммамипродуцентами антибиотиков, причем эти различия могут быть количественными иликачественными. Один штамм, например, дает максимальный выход данного антибиотика, когда культурарастет на поверхности среды и находится в стационарных условиях, а другой - лишь когда его культурапогружена в среду и постоянно встряхивается. Некоторые микроорганизмы выделяют не один, а несколькоантибиотиков. Так, Pseudomonas aeruginosa образует пиоцианазу, пиоцианин, пиолипоевую кислоту и другиепиоцианиновые
соединения; Bacillus brevis производит грамицидин и тироцидин (смесь, известную под названиемтиротрицин); P. notatum - пенициллин и пенатин; Aspergillus flavus - пенициллин и аспергилловую кислоту;Aspergillus fumigatus - фумигатин, спинулозин, фумигацин (гельволевую кислоту) и глиотоксин; Streptomycesgriseus - стрептомицин, маннозидострептомицин, циклогексимид и стрептоцин; Streptomyces rimosus -окситетрациклин и римоцидин; Streptomyces aureofaciens - хлортетрациклин и тетрациклин. Один и тот жеантибиотик может продуцироваться микроорганизмами разного рода. Так, глиотоксин образуют видыGliocladium и Trichoderma, а также Aspergillus fumigatus и др. Разные микрорганизмы или их штаммы могутвырабатывать разные химические формы одного и того же антибиотика, например разные пенициллины илиразличные формы стрептомицина. В последние годы выделено и описано огромное число антибиотиков,продуцируемых различными организмами. Способностью вырабатывать антибиотики обладают какспорообразующие, так и не образующие спор бактерии, а кроме того, более половины изученных на этотпредмет родов грибов.
Неспорообразующие бактерии. Из группы бактерий, ранее называемых Bacillus pyocyaneus, а позднееизвестных как Pseudomonas aeruginosa, выделены пиоцианин и пиоцианаза. Другие не образующие спорбактерии тоже вырабатывают антибиотики, сильно различающиеся по химической структуре иантибактериальным свойствам. Примером могут служить колицины, производимые различными штаммамикишечной палочки (Escherichia coli).
Спорообразующие бактерии. Многие виды спорообразующих бактерий вырабатывают различныеантибиотики. Так, штаммы Bacillus subtilis производят бацитрацин, субтилин и др.; B. brevis - тиротрицин, B.polimixa (B. aerosporus) - полимиксин (аэроспорин). Из B. mycoides, B. mesentericus и B. simplex выделеныразнообразные, еще недостаточно изученные соединения: бациллин, колистатин и др. Многие из нихпрепятствуют росту грибков.
Закрепление: выполнение заданий в рабочей тетради
Задание на дом: подготовить реферат по данной теме
ЖАМБЫЛ ОБЛЫСЫ Т.РЫСҚҰЛОВ АУДАНЫ ӘКІМДІГІНІҢ БІЛІМ БӨЛІМІНІҢ
«АҚТОҒАН ОРТА МЕКТЕБІ» КОММУНАЛДЫҚ МЕМЛЕКЕТТІК МЕКЕМЕСІ
.
«Основы молекулярной биологии»
Рабочая тетрадь
11 класс
Учитель биологии Ахимбекова Айман Несипбаевна
Когершин 2016 год
Урок №1
Тема: Компоненты ядра
Заполни таблицу.
Назови органеллы клетки
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
6 |
|
|
7 |
|
|
8 |
|
|
9 |
|
|
10 |
|
|
11 |
|
|
12 |
|
|
13 |
|
|
14 |
|
|
15 |
|
Урок № 2
Тема: Ядерная оболочка
Дополните предложения
-
В чём заключается функции плазматической мембраны……………………………………………………………………………………………………………………………………………………………………………………………….
-
Как взаимосвязано ее строение с функциями в клетке………………………………………………………………………………………………………………………………………………………………………………………………………
-
Какова роль цитоплазмы в клетке………………………………………………………………………………………………………………………………………………………………………………………………………
-
Заполните таблицу
|
Название компонентов и органоидов клетки |
Строение |
Функции |
|
|
|
|
Урок № 3
Тема урока: Эволюционное значение ядра
Дополните предложения
-
Какие вещества называются органическим? Какие биополимеры вы знаете?.............................................................................................................................................................................................................................................................................................................................................................................................................................................................................
-
Вставьте пропущенное: Молекула полимера состоит ………………………………………………………………………………………………………
………………………………………………………………………………………………………
К мономера углеводов относятся…………………………………………………………………
………………………………… Их молекулы состоят из………………….……………атомов.
-
Заполните таблицу
-
Название
Местонахождение в клетке и в организме
Выполняемые функции
-
Моносахариды
-
Полисахариды
-
Урок № 4
Тема урока: Происхождение ядра
-
Основное функциональное отличие клеток эукариот от клеток прокариот заключается в………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Задача. В результате энергетического обмена в клетке образовалось 5 моль молочной
кислоты и 27 моль углекислого газа.
Определите:
а) сколько всего моль глюкозы израсходовано?
б) сколько из них подверглось полному расщеплению, а сколько гликолизу?
в) сколько энергии запасено?
г) Сколько моль кислорода пошло на окисление?
Урок № 5
Тема урока: Молекулярный механизм.
Дополните предложения
-
Опишите особенности репликации ………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Допишите предложение: Белковая молекула относится к сложным………………… Роль мономеров белка выполняют…………………… ………………………….., в состав молекулы которых входят атомы………………………………………….. .
3. Даны два звена молекул биополимеров: 1) А-Б-К-С-И-В-А-П;
2) Г-Г-Г-Г-Г-Г-Г. Какое из этих звеньев – углевод а какое – белковая молекула?
Ответ поясните.
4.Белки подразделяются на……………………………… , простые белки называются ……………………. , сложные …………………………… . К простым белкам относятся ……………………………., к сложным белкам относятся……………………………. .
Урок № 6
Тема урока: Репликация основной части ДНК
Дополните предложения
-
Репликация ДНК — ключевое событие в ходе ………………………………Принципиально, чтобы к моменту …………………. ДНК была реплицирована полностью и при этом только один раз. Это обеспечивается определёнными механизмами ……………………….. ………………………. ДНК.
-
Репликация проходит в три этапа:
-
……………………………………….
-
……………………………………….
-
……………………………………….
3.Опишите функции репликации ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 7
Тема урока: Репликация теломерных отделов
Дополните предложения
-
В клеточном геноме обратные транскриптазы ……………………… в ретротранспозонах.
- РНК, используемая ……………………………….. для синтеза …………………………. ДНК в качестве матрицы, входит в состав этого ……………………. . В этом уникальность ………………… на сегодня это единственая известная …………………………… обратная транскриптаза
-
Теломераза – это……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 8
Тема урока: Механизм действия теломеразы
Дополните предложения
-
Реплика́ция — процесс ………………………………………………………… дочерней молекулы…………………………………………………………… на матрице родительской молекулы ДНК. В ходе последующего деления …………………………………. ………………………………….. каждая дочерняя клетка получает по …………………………. копии молекулы ДНК, которая является …………………………….. ДНК исходной ………………….клетки.
-
Каждая молекула ДНК состоит из …………….цепи исходной родительской молекулы и одной вновь ……………………………. цепи. Такой механизм …………………….. называется полуконсервативным.
Урок № 9
Тема урока: Механизмы действия теломер в соматических клетках
Дополните предложения
-
Существует некоторая ………………………….. длина теломеры, когда ……………… еще разрешено. Иными словами, ………………………. ………………………. наступает до того, как начал разрушаться ……………………….текст генома.
-
Старение особи - это нормальная ……………………… функция, способствующая прогрессивной ………………………. вида, размножающегося ……………………… путем.
Урок № 10
Тема урока: Теломераза, рак и старение
-
Высокая ……………………………….. активность наблюдается в ………………………. клетках ………………………….. в течение всей его жизни.
-
Соответственно их теломеры состоят из ……………………… числа ДНК-повторов и содержат все ……………………………….. …………………….. для нормальной пролиферации клеток.
Урок № 11
Тема урока: Метилирование ДНК
Ответьте на вопросы
-
Что такое нуклеоотид?.....................................................................................................................................................................................................................................................................................................
-
Ондоспиральные и двусприальные нуклеотиды…………………………………………………………………………………………………………………………………………………………………………………………………
-
Какими соединения связываются между собой нуклеотиды ………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Как связывается между собой двусприальнаяДНК?.....................................................................................................................................................................................................................................................................................................................................................................................................................................................
Заполните таблицу
|
Нуклейновые кислоты |
Строние молекулы |
Располежение в клетку |
Роль в клетке |
|
|
|
|
|
Урок № 12
Тема урока: Метилирование ДНК у человека
Дополните предложения
-
Метилирование ДНК — это …………………….. ………………………… ДНК без изменения самой …………………………………………. ……………………………………..ДНК, что можно рассматривать как часть …………………… …….. составляющей генома.
-
Опираясь на комплементарность нуклеотидов составьте вторую цепь ДНК
ГЦ АТ
ГА АТ
ЦГ ЦА
АА АЦ
Урок № 13
Тема урока: Роль метилирование в онкогенезе
Дополните предложения
-
Сопоставление данных по …………………. людей, предрасположенных к онкологическим…………………………………………….., с профилем …………………………….. их ДНК позволило предположить, что примерно в 20% случаев …….................................. ………………………………….обнаруживается взаимосвязь между уровнем ……………………………….. определенных ………………….. и полиморфизмами генов, связанных с ……………………….заболевания раком.
-
Задача. Дана молекула ДНК с относительной молекулярной массой 69000, из них 8625 приходится на долю адениловых нуклеотидов. Найдите количество всех нуклеотидов в этой ДНК. Определите длину этого фрагмента.
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Урок № 14
Тема урока: Репликация повреждения ДНК
-
Задача. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 18%. Определите процентное содержание других нуклеотидов в этой ДНК.
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
-
Задача. В молекуле ДНК обнаружено 880 гуаниновых
нуклеотидов, которые составляют 22% от общего числа нуклеотидов в этой ДНК.
Определите: а) сколько других нуклеотидов в этой ДНК? б) какова длина этого фрагмента?
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 15
Тема урока: Повреждение оснований
Дополните предложения:
-
Если разрывы в каждой из ……………………. расположены рядом, то
это может привести к……………………………………………… хромосомы. Пути снижения дестабилизирующего эффекта алкилирующих соединений на ………………………………….. включают………………………………, обмен сестринскими…………………………………...., разрушение или ………………………………………………. хромосом.
-
Эти атомы кислорода обычно находятся в …………………………………………
для правильного ………………………….оснований. Однако этилирование …………………….. …….. эти атомы в…………………………………… ………………………………, таким образом, дестабилизируя обычное углеродное ………………………… между основаниями в противоположных цепях, что часто приводит к возникновению ……………………….. мутации.
Урок № 16
Тема урока: Преждевременная терминация белковой цепи
Дополните предложения
-
В первом случае можно пересадить …………………. Из…………….. ……………. кишечного ……………………………… головастика в ……………………. с убитым с помощью ……………………………………. облучения ядром. Из такой синтезированной клетки ……………………………………. нормальная лягушка.
-
Во втором случае клетки передней части…………………………. дрозофилы способны …………………………… только структуры……………………. части тела имаго, а клетки задней части бластодермы только ……………………. задней части тела
Урок № 17
Тема урока: Строение и функции хромасом
Дополните предложения:
-
Хромосомы выполняют функцию …………………………………………………… ………………………………………….аппарата клетки. В них в линейном порядке……………………………………….. …………………………………, каждый из которых занимает строго определенное место (локус) в……………………………………….. В каждой хромосоме…………………………………. ……………………, но для нормального развития организма необходим ………………………………… …………………………….полного хромосомного набора
Задача. На фрагменте одной нити ДНК нуклеотиды расположены в последовательности:
А-А-Г-Т-Ц-Т-А-Ц-Г-Т-А-Т.
Определите процентное содержание всех нуклеотидов в этом гене и его длину.
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок № 18
Тема урока: Организация генетического материала способ записи
Дополните предложения:
-
В состав каждого мономера ДНК входит углевод пентоза ………………………………………………….. напротив азотистого основания аденина находится …………………………. тимин через …………………………………. связь дополняет аденин находится………………. …………………………. связь дополняет собой………………………..
2. Мономеры ДНК соединаются между собой через углевод и остаток фосфорной кислоты Это называется …………………………………… эти две ……………………………. ..соединяются между собой.
По сравнению с другими нуклеотидами …………………………………. в молекула ДНК составляет 30% определите количество других нуклеотидов
Урок № 19
Тема урока: Способ записи генетической информации в молекуле ДНК. Биологический код и его свойства.
Дополните предложения:
-
Небольшая часть молекулы ДНК состоит из следующей цепи: ЦАА – АЦА – ААА достройте вторую цепь ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
-
Порядок расположения нуклеотидов на участке цепи такое А-И-Т-Ц-Т-Г-А-Ц-Т-Г- Определите соответствующую ей вторую цепь ДНК ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………...
-
В процессеудвоении ДНК образующий молекулы. В какой из новых молекул сохранены принцип комплементарности?....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Урок № 20
Тема урока: Оперонная организация генетического материала у бактерий.
Дополните предложения:
-
При определенных условиях с ………………………………….. ………………………….. специфический белок-репрессор, и это ……………………………………….. «прочтение» РНК-полимеразой ………………………………….. группы генов. У эукариот регуляцию «прочтения» ……………………………………….. осуществляют не только белки-репрессоры, но и белки-активаторы — ……………………………………………… факторы
-
Эти факторы имеются во всех ………………………………..и необходимы для «прочтения» любого ………………………………………… гена. Другие транскрипционные факторы ……………………………………….активность только …………………………………генов, и локусы ДНК, …………………………………. … такие факторы, называются энхансерами.
Урок № 21
Тема урока: Конститутивные гены и белки
Дополните предложения:
-
В триптофановом опероне, как и…………………………, тоже имеется двойной механизм регуляции. Во-первых, как обычно, …………………………………. ……………………………. РНК-полимеразы по оператору.
-
В процессе …………………………………………….этого отдела образуется лидерный участок мРНК. Последний тут же …………………………………….. ………………………….. и начинает …………………………………с образованием лидерного пептида (ЛП).
Урок № 22
Тема урока: Количественные особенности генома эукариот
Дополните предложения:
-
Низкочастотные повторы …………………………….., повторяющиеся десятки раз.
Промежуточные, или…………………………, повторы последовательности, ……………… сотни и тысячи раз.
-
Таким образом, в случае высокочастотных …………………………………. ДНК обнаруживается тождество молекулярной организации и ………………….. свойств ………………………… ДНК эукариот
Урок № 23
Тема урока: Конститутивные гены и белки.
Дополните предложения
-
Дополнително предложения: Разрушение природой структуры белка называют …………… Белок ускоряющий реакцию биоцинтез называется ………………. Газы транспоттируются белком ………………………….. Белок – источник…………….. Белок защищающий от чужеродных тел называются………………………..
2.Решите задачу.
Задача №1. Гемоглобин крови человека содержит 0, 34% железа. Вычислите минимальную молекулярную массу гемоглобина.
Решение:………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Задача№2 Альбумин сыворотки крови человека имеет молекулярную массу 68400. Определите количество аминокислотных остатков в молекуле этого белка.
Решение:…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Урок №24
Тема урока: Особенности репликации эукариотических хромосом
Дополните предложения
-
У многоклеточных эукариот в ходе ………………………………… из исходной клетки развивается ………………………… организм. На разных этапах ……………………….. в разных ………………………..с разной …………………………….. экспрессируются разные гены.
-
Заполни таблицу
Сравните сходство и различия клеток эукариот
|
Строение
|
Эукариотическая клетка |
Прокариотическая клетка |
|
|
|
|
Урок № 25
Тема урока: Структура РНК
Дополните предложения
-
Углевод входящий в состав
-
РНК…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
При денатурации белок? ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Мономер РНК, по которому отличается от ДНК……………………....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
-
Задача Вирусом табачной мозаики (РНК — овый вирус) синтезируется участок белка с аминокислотной последовательностью: Ала – Тре – Сер – Глу – Мет-
Под действием азотистой кислоты (мутагенный фактор) цитозин в результате дезаминирования превращается в урацил. Какое строение будет иметь участок белка вируса табачной мозаики, если все цитидиловые нуклеотиды подвергнутся указанному химическому превращению?
Решение:…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Урок №26
Тема урока: Синтез РНК.
Задача В процессе энергетического обмена произошло расщепление 7 моль глюкозы, из которых полному подверглось только 2.Определите:………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
а) сколько моль молочной кислоты и СО2 при этом образовалось?...........................................................................................................................................................................................................................................................................................................................
б) сколько АТФ при этом синтезировано?.........................................................................................................................................................................................................................................................................................................................
в) сколько энергии запасено в этих молекулах АТФ?..........................................................…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок №27
Тема урока Синтез ДНК
-
Задача Последовательность нуклеотидов в начале гена, хранящего информацию о белке инсулине, начинается так:
АААЦАЦЦТГЦТТГТАГАЦ
Напишите последовательности аминокислот, которой начинается цепь инсулина
Решение: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
-
Задача Что тяжелее: белок или его ген?
Решение:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………
Урок №28
Тема урока: Созревание РНК
1. Задача Белок содержит 0,5% глицина. Чему равна минимальная молекулярная масса этого белка, если Мглицина = 75,1? Сколько аминокислотных остатков в этом белке?
Решение: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
2.Допишите предложения: Кодон состоит из четырёх …………………………… Они, объединялись по двое, образуют соответствие ……………………………………………РНК образуется в процессе ………………… …………………………… В процессе……………… происходит синтез………………………… .
-
В чем заключает роль кодон УАА УАГ УГА при биосинтез белка?.................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
-
Дайте объяснение данной схемы: ДНК и РНК белок ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………............................................................................................................................................................................
Урок №29
Тема урока: Распад мРНК
Допишите предложения
-
Различают …………………………………………., разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие ……………………………………… ………………………………. с образованием ……………………………, и экзонуклеазы, катализирующие ……………………………отщепление концевых мононуклеотидов.
-
Как называется номер ДНК …………………………………………………………………Какие нуклеотиды входят в макромолекулы РНК ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок №30
Тема урока: Трансляция мРНК у эукариот
Допишите предложения
-
Процесс трансляции ……………………………………… мРНК в основном аналогичен таковому ……………………………………. мРНК. За некоторыми ……………………. ……………………… исключениями, ………………………………………… код универсален и кодоны последовательно ……………………………… с помощью специфических аминоцил тРНК-синтез на рибосомах.
-
Наличие какого мономера РНК отличается от ДНК…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Урок №31
Трансляция мРНК у прокариот
Допишите предложения
-
При этом ………………………..группа уже образовавшегося участка………………………. цепи соединяется с …………………………….. следующей ……………………………. аминокислоты с помощью ……………………………. связи.
-
Это может……………………………………, лишь если ………………………….. конец растущей ……………………………….. цепи находится в …………………………….. состоянии.
-
Назовите углевод входящий в состав РНК ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Урок №32
Тема урока: Фолдинг белка
Допишите предложения
-
Для стабилизации ……………………………………………………..структуры многие белки в клетке подвергаются ……………………………… модификации. Весьма часто встречаются …………………………………. мостикимежду …………………………….. близкими участками ……………………………………… цепи.
-
Для корректной …………………………… белков весьма важна правильная …………………………….. структура. Ошибки ………………………………… обычно приводят к образованию ………………………………… белка с ……………………………. свойствами.
Урок №33
Тема: Модификация белков
Допишите предложения
-
Характерные особенности этих …………………………………. наличие на конце ……………………………. положительно………………………………………. участка, за которым следует …………………………….. участок, содержащий от 7 до 14 амино кислотных остатков.
-
Для стабилизации …………………………………. структуры многие белки в клетке подвергаются ………………………………….. модификации. Весьма часто встречаются ………………………………….. мостик и между …………………………….. близкими участками ………………………………….. цепи.
Урок №34
Тема урока: Получение антибиотиков.
Допишите предложения
-
Разные микрорганизмы или их штаммы могут………………………………. разные ………………………. формы одного и того же …………………………, например разные ………………………………. или различные формы стрептомицина.
-
В последние годы …………………………………….. и описано ……………………… число антибиотиков,……………………………… различными организмами.
-
Какие микроорганизмы вырабатывают антибиотики…………………………………………………………………………………………………………………………………………………………………………………………………………….…………………………………………………………………………………………………………………………………………………………………………………………

шағым қалдыра аласыз