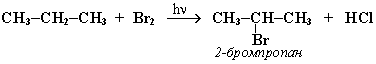План урока
|
Раздел долгосрочного плана: |
Бастобинский сервисно-технический колледж |
||
|
Дата: |
ФИО учителя: Ахметова Дана Асетовна |
||
|
Группа: 202 ЕМН |
Количество присутствующих: |
отсутствующих: |
|
|
Тема урока |
Получение галогеналканов |
||
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) |
- объяснять радикальный
механизм реакций получения галогеноалканов; |
||
|
Цели урока |
|
||
|
Критерии оценивания |
Учащийся достигнет цели, если будет:
|
||
|
Языковые цели |
Предметная лексика и терминология замещение, элиминирование (дегидратация), хлорфторированный, (хлорфторуглерод), озон, синтез Серия полезных фраз для диалога/письма Значимость растворителя заключается в… Если галогеноалкан первичный, то… Высокие температуры вызывают… Оптимальными условиями для реакций замещения (элиминирования) являются… |
||
|
Предварительные знания |
9.4В Углеводороды. Топливо 10.1C Химическая связь 10.2A Введение в органическую химию |
||
Ход урока.
|
Запланированные этапы урока |
Запланированная деятельность на уроке учителя |
Запланированная деятельность на уроке ученика |
Оценивание |
Ресурсы |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Начало урока 0 – 10 мин
|
Приветствие. Активизация класса. Задание 1 Сопоставьте формулы галогеналканов с их названиями CH3Cl йодэтан (хлороформ) Учитель совместно с учащимися формулирует тему и цели урока, критерии оценивания. |
Задание 1 Дескриптор: Сопоставляют формулы галогеналканов с их названиями. |
Само оценивание |
Раздаточный материал- карточки Химия_10_ЕМН Презентация_ 1-4 слайд |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Середина урока 6 – 15 мин 15-30 мин 30-75 мин |
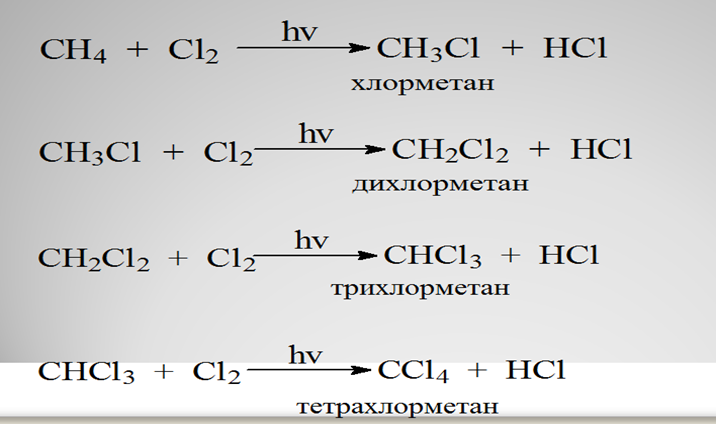
(И) (О) Предложите учащимся записать реакцию хлорирования метана, объяснить значение ультрафиолетового излучения в данной реакции, а также природу реагирующих веществ. (Г или К) Объедините учащихся в группы, предложите рассмотреть механизм данной реакции, которая протекает в три стадии: инициирования, роста и обрыва цепи. Может ли реакция хлорирования алкана прекратиться самопроизвольно? Обсуждение с учителем. Обратная связь Реакции замещения В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C. В определенных условиях происходит разрыв именно С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов. Галогенирование Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании. Хлорирование метана:
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
Реакция галогенирования
алканов протекает по радикальному цепному механизму, т.е. как цепь
последовательных превращений с участием свободно-радикальных
частиц. Механизм радикального замещения
(символ SR):
2 стадия – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
(Реакция
Cl· +
CH4 ® CH3Cl +
H· не идет, т.к. энергия атомарного
3 стадия – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений: При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
(У, И) Предложите учащимся работу с текстом учебника о промышленном применении хлор - и фторалканов. После работы с текстом предложить учащимся составить интеллект-карту о применении данных галогеноалканов. Фторуглероды получают из углеводородов при замещении фтором
некоторых или всех атомов водорода. Углеводороды, в которых
некоторые из атомов водорода, в дополнение к замещенным фтором,
замещены хлором или бромом, например, хлорфторуглеводороды,
бромфторуглеводороды, также относят к фторзамещенным
углеводородам. Предложите учащимся из представленных реакций определить реакции замещения, протекающие по свободно радикальному механизму, которые встречаются в курсе органической химии. |
Дескриптор: Записывает реакция хлорирования метана Задание: Может ли реакция хлорирования алкана прекратиться самопроизвольно? Дескриптор: Определяет может ли реакция хлорирования алкана прекратиться самопроизвольно?
Работает с текстом учебника о промышленном применении хлор - и фторалканов. Составляют интелект карту «Применение галогеноалканов» Дескриптор: Находит область применения данных соединений и проблемы окружающей среды, связанные с влиянием галогеноалканов
Здание. Из представленных реакций определить реакции замещения, протекающие по свободно радикальному механизму, которые встречаются в курсе органической химии. Дескриптор: Определяет реакцию замещения. |
Само оценивание
Самооценивание
Взаимооценивание
Самооценивание |
Химия_10_ЕМНПрезентация слайд 4 Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
План урока Раздел долгосрочного
плана: Бастобинский
сервисно-технический колледж Дата: ФИО учителя: Ахметова Дана
Асетовна Группа: 202
ЕМН Количество
присутствующих: отсутствующих: Тема урока Получение
галогеналканов Цели обучения, которые
достигаются на данном уроке (ссылка на учебную
программу) - объяснять радикальный
механизм реакций получения галогеноалканов; Цели урока объяснять радикальный механизм
реакций получения галогеноалканов; выявлять проблемы окружающей
среды, связанные с влиянием
галогеноалканов Критерии оценивания Учащийся достигнет цели,
если будет: объяснять радикальный механизм
реакций получения галогеноалканов; выявлять проблемы окружающей
среды, связанные с влиянием
галогеноалканов Языковые цели Предметная лексика и
терминология замещение, элиминирование
(дегидратация), хлорфторированный, (хлорфторуглерод), озон,
синтез Серия полезных фраз для
диалога/письма Значимость растворителя
заключается в… Если галогеноалкан первичный, то… Высокие
температуры вызывают… Оптимальными условиями для реакций замещения
(элиминирования) являются… Предварительные знания 9.4В Углеводороды.
Топливо 10.1C Химическая
связь 10.2A Введение в органическую
химию
Ход
урока. Запланированные этапы
урока Запланированная
деятельность на уроке учителя Запланированная
деятельность на уроке ученика Оценивание Ресурсы Начало урока 0 –
10 мин Приветствие. Активизация
класса. Задание
1 Сопоставьте формулы
галогеналканов с их названиями CH3Cl йодэтан (хлороформ) Учитель совместно с учащимися
формулирует тему и цели урока, критерии
оценивания. Задание
1 Дескриптор: Сопоставляют формулы
галогеналканов с их названиями. Само
оценивание Раздаточный материал-
карточки Химия_10_ЕМН Презентация_ 1-4
слайд Середина
урока 6 – 15
мин 15-30
мин 30-75
мин (И)
(О) Предложите учащимся записать
реакцию хлорирования метана, объяснить значение ультрафиолетового
излучения в данной реакции, а также природу реагирующих
веществ. (Г или К)
Объедините учащихся в группы, предложите
рассмотреть механизм данной реакции, которая протекает в три
стадии: инициирования, роста и обрыва
цепи.
Может ли реакция хлорирования алкана
прекратиться самопроизвольно?
Обсуждение с учителем. Обратная
связь
Реакции
замещения
В молекулах алканов
связи C-Н пространственно более
доступны для атаки другими частицами, чем менее прочные
связи C-C. В определенных условиях
происходит разрыв именно С-Н-связей и осуществляется замена атомов
водорода на другие атомы или группы
атомов.
Галогенирование
Галогенирование алканов –
реакция замещения одного или более атомов водорода в молекуле
алкана на галоген. Продукты реакции называют галогеналканами или
галогенопроизводными алканов. Реакция алканов с хлором и бромом
идет на свету или при нагревании.
Хлорирование
метана:
При достаточном количестве
хлора реакция продолжается дальше и приводит к образованию смеси
продуктов замещения 2-х, 3-х и 4-х атомов
водорода:
Реакция галогенирования
алканов протекает по радикальному цепному механизму, т.е. как цепь
последовательных превращений с участием свободно-радикальных
частиц. Механизм радикального замещения
(символ SR): 2 стадия
– рост (развитие)
цепи. Свободные радикалы, взаимодействуя с
молекулами, порождают новые радикалы и развивают цепь
превращений: (Реакция
Cl· +
CH4 ® CH3Cl +
H· не идет, т.к. энергия атомарного 3 стадия
– обрыв
цепи. Радикалы, соединяясь друг с другом,
образуют молекулы и обрывают цепь
превращений:
При хлорировании или
бромировании алкана с вторичными или третичными атомами углерода
легче всего идет замещение водорода у третичного атома, труднее у
вторичного и еще труднее у первичного. Это объясняется большей
устойчивостью третичных и вторичных углеводородных радикалов по
сравнению с первичными вследствие делокализации неспаренного
электрона. Поэтому, например, при бромировании пропана основным
продуктом реакции является
2-бромпропан:
(У,
И) Предложите учащимся работу с
текстом учебника о промышленном применении хлор - и фторалканов.
После работы с текстом предложить учащимся составить
интеллект-карту о применении данных
галогеноалканов. Фторуглероды получают из углеводородов при замещении фтором
некоторых или всех атомов водорода. Углеводороды, в которых
некоторые из атомов водорода, в дополнение к замещенным фтором,
замещены хлором или бромом, например, хлорфторуглеводороды,
бромфторуглеводороды, также относят к фторзамещенным
углеводородам. Предложите учащимся из представленных реакций
определить реакции замещения, протекающие по свободно радикальному
механизму, которые встречаются в курсе органической
химии. Дескриптор: Записывает реакция
хлорирования метана
Задание:
Может ли реакция хлорирования алкана
прекратиться самопроизвольно?
Дескриптор:
Определяет может ли реакция хлорирования алкана
прекратиться самопроизвольно? Работает с текстом
учебника о промышленном применении хлор
- и фторалканов. Составляют интелект карту
«Применение галогеноалканов» Дескриптор: Находит область применения
данных соединений и проблемы окружающей среды, связанные с влиянием
галогеноалканов Здание.
Из представленных реакций определить реакции
замещения, протекающие по свободно радикальному механизму, которые
встречаются в курсе органической
химии. Дескриптор:
Определяет реакцию
замещения. Само
оценивание Самооценивание Взаимооценивание Самооценивание Химия_10_ЕМНПрезентация слайд
4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||