КГКП «Геологоразведочный колледж»
Поурочный план № 1
|
Тема урока |
Состав и строение атома |
|
Курс, группа |
1 курс группа ОС-01 |
|
Наименование модуля/дисциплины |
ООД 12 Химия |
|
Преподаватель |
Оспанова А.К. |
|
Дата |
|
|
Тип урока |
Обьяснение новой темы |
|
Цели обучения |
Все учащиеся научатся:
Большинство учащихся научится: -Объяснять природу радиоактивности и причину распада радиоактивных изотопов; Некоторые учащиеся научатся: - Понимать условия протекания ядерных реакций. Дать понятие о составе атома и составе атомного ядра Раскрыть взаимосвязь понятий: протон; нейтрон; массовое число Дать понятие о ядерных реакциях и изотопах Дать современное определение понятия „химический элемент” |
|
Критерии оценивания |
Учащиеся: 1)владеет основными положениями современной теории строения атома; 2)понимает физический смысл протонов, нейтронов, электронов, нуклонов и нуклидов; 3)разбирается в понятиях изотопы, изотоны; |
|
Учебно-методическое, техническое оснащение, справочная литература |
М.К. Оспанова Химия 10кл, smk https://smk.edu.kz/ |
|
Межпредметные связи: |
физика |
Ход урока
|
Планируемые сроки |
Планируемые действия |
Ресурсы |
|
0-5 мин. |
1. ОРГАНИЗАЦИОННЫЙ МОМЕНТ - Приветствие, отметка присутствующих - совместно с учащимися определить цели урока/ЦО - совместно с учащимися определить «зону ближайшего развития» учащихся, ожидания к концу урока. |
Журнал, |
|
Начало урока 5 мин.
|
2. АКТУАЛИЗАЦИЯ ЗНАНИЙ Самостоятельная работа 1.В предложение вставьте слова „атом” и „молекула” а)…водорода образована … водорода. б)…углекислого газа образована …углерода и …кислорода . в)…серной кислоты состоит из двух…водорода одного …серы и четырех …кислорода. г) …белого фосфора состоит из четырех … фосфора. 2.Составьте формулы данных веществ, укажите простые и сложные вещества. H2; CO2; H2SO4; P4 Заслушать ответы учащихся (предположения) Объявить тему урока: Состав и строение атома 3.Сформулируйте основные положения атомно-молекулярного учения. Основные положения атомно-молекулярного учения:
Основой всех веществ является атом. Атом - сложная частица
|
Презентация2 |
|
15мин |
3. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Первый постулат. Электрон движется вок руг ядра по строго определенным замкнутым стационарным орбитам в соответствии с «разрешенными» значениями энергии Е1Е2, ..., Еn.
Н. Бор внес квантовые представления в строение атома, но использовал при этом традиционные классические понятия механики, рассматривая электрон как частицу, движущуюся со строго определенными скоростями по строго определенным траекториям. |
Презентация 2, М.К. Оспанова Химия 10кл |
|
Середина урока 15мин |
Планетарная модель атома Атом –это микрочастица, которая имеет форму шара.
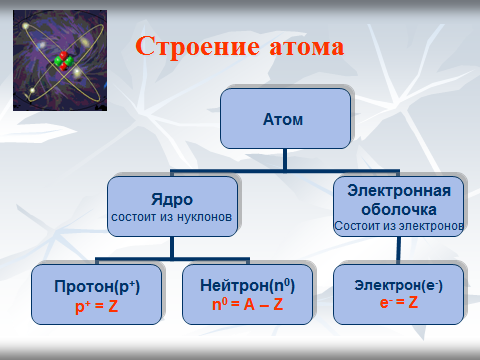
Самостоятельная работа: 1) Укажите состав атома железа 2656Fe (26p++30n0) 26e- 2) Укажите состав ядра атома железа 2656Fe (26p++30n0) 3)Укажите состав атома фосфора, состав ядра атома цинка 1531P (15p++16n0) 15e- 3065Zn (30p++35n0) Что произойдет с атомом элемента, если в его ядре изменить число протонов? Например, в ядро атома фосфора добавить один протон. 15P (15p++16n0)+p+ Получится ядро другого химического элемента- серы 16S (16p++16n0) А=32 В результате ядерных реакций получаются новые химические элементы. 15P+p+= 16S Что произойдет с атомом элемента, если в его ядре изменить число нейтронов? Например, в ядро атома фосфора добавить один нейтрон. 15P (15p++16n0)+n0 15P (15p++17n0) А=32 Получился изотоп фосфора, у которого массовое число- 32. Укажите состав изотопов хлора:35Сl и37Сl 1735Сl(17p++18n0) 17е- А=35 1737Сl(17p++20n0) 17е- А=37 Атомы изотопов одного элемента имеют одинаковое число протонов и электронов, но разное число нейтронов. Химический элемент- это совокупность атомов с одинаковым зарядом ядра. |
|
|
Заверше ние урока 4мин |
Задачи:
Z=19. Элемент - калий. 1939К (19p++20n0) 19e-
Аr(Cl)=35x0,75+37x0,25= 26,25+9,25=35,5 |
М.К. Оспанова Химия 10кл |
|
5мин |
Возврат к ЦО Рефлексия:
|
|
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Строение атома
Строение атома
КГКП «Геологоразведочный колледж»
Поурочный план № 1
|
Тема урока |
Состав и строение атома |
|
Курс, группа |
1 курс группа ОС-01 |
|
Наименование модуля/дисциплины |
ООД 12 Химия |
|
Преподаватель |
Оспанова А.К. |
|
Дата |
|
|
Тип урока |
Обьяснение новой темы |
|
Цели обучения |
Все учащиеся научатся:
Большинство учащихся научится: -Объяснять природу радиоактивности и причину распада радиоактивных изотопов; Некоторые учащиеся научатся: - Понимать условия протекания ядерных реакций. Дать понятие о составе атома и составе атомного ядра Раскрыть взаимосвязь понятий: протон; нейтрон; массовое число Дать понятие о ядерных реакциях и изотопах Дать современное определение понятия „химический элемент” |
|
Критерии оценивания |
Учащиеся: 1)владеет основными положениями современной теории строения атома; 2)понимает физический смысл протонов, нейтронов, электронов, нуклонов и нуклидов; 3)разбирается в понятиях изотопы, изотоны; |
|
Учебно-методическое, техническое оснащение, справочная литература |
М.К. Оспанова Химия 10кл, smk https://smk.edu.kz/ |
|
Межпредметные связи: |
физика |
Ход урока
|
Планируемые сроки |
Планируемые действия |
Ресурсы |
|
0-5 мин. |
1. ОРГАНИЗАЦИОННЫЙ МОМЕНТ - Приветствие, отметка присутствующих - совместно с учащимися определить цели урока/ЦО - совместно с учащимися определить «зону ближайшего развития» учащихся, ожидания к концу урока. |
Журнал, |
|
Начало урока 5 мин.
|
2. АКТУАЛИЗАЦИЯ ЗНАНИЙ Самостоятельная работа 1.В предложение вставьте слова „атом” и „молекула” а)…водорода образована … водорода. б)…углекислого газа образована …углерода и …кислорода . в)…серной кислоты состоит из двух…водорода одного …серы и четырех …кислорода. г) …белого фосфора состоит из четырех … фосфора. 2.Составьте формулы данных веществ, укажите простые и сложные вещества. H2; CO2; H2SO4; P4 Заслушать ответы учащихся (предположения) Объявить тему урока: Состав и строение атома 3.Сформулируйте основные положения атомно-молекулярного учения. Основные положения атомно-молекулярного учения:
Основой всех веществ является атом. Атом - сложная частица
|
Презентация2 |
|
15мин |
3. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Первый постулат. Электрон движется вок руг ядра по строго определенным замкнутым стационарным орбитам в соответствии с «разрешенными» значениями энергии Е1Е2, ..., Еn.
Н. Бор внес квантовые представления в строение атома, но использовал при этом традиционные классические понятия механики, рассматривая электрон как частицу, движущуюся со строго определенными скоростями по строго определенным траекториям. |
Презентация 2, М.К. Оспанова Химия 10кл |
|
Середина урока 15мин |
Планетарная модель атома Атом –это микрочастица, которая имеет форму шара.
Самостоятельная работа: 1) Укажите состав атома железа 2656Fe (26p++30n0) 26e- 2) Укажите состав ядра атома железа 2656Fe (26p++30n0) 3)Укажите состав атома фосфора, состав ядра атома цинка 1531P (15p++16n0) 15e- 3065Zn (30p++35n0) Что произойдет с атомом элемента, если в его ядре изменить число протонов? Например, в ядро атома фосфора добавить один протон. 15P (15p++16n0)+p+ Получится ядро другого химического элемента- серы 16S (16p++16n0) А=32 В результате ядерных реакций получаются новые химические элементы. 15P+p+= 16S Что произойдет с атомом элемента, если в его ядре изменить число нейтронов? Например, в ядро атома фосфора добавить один нейтрон. 15P (15p++16n0)+n0 15P (15p++17n0) А=32 Получился изотоп фосфора, у которого массовое число- 32. Укажите состав изотопов хлора:35Сl и37Сl 1735Сl(17p++18n0) 17е- А=35 1737Сl(17p++20n0) 17е- А=37 Атомы изотопов одного элемента имеют одинаковое число протонов и электронов, но разное число нейтронов. Химический элемент- это совокупность атомов с одинаковым зарядом ядра. |
|
|
Заверше ние урока 4мин |
Задачи:
Z=19. Элемент - калий. 1939К (19p++20n0) 19e-
Аr(Cl)=35x0,75+37x0,25= 26,25+9,25=35,5 |
М.К. Оспанова Химия 10кл |
|
5мин |
Возврат к ЦО Рефлексия:
|
|

шағым қалдыра аласыз