
Поурочный план педагога для организаций технического и профессионального, послесреднего образования
Тема 4. Комплексные соединения.
(тема
занятия)
Наименование модуля /дисциплины
_________ химия__________
Подготовил педагог ____________________"__"____________ 20_
года
1. Общие сведения
Курс, группы _________ Лаб-02-20, Лаб-02-21
Тип занятия___________________Теория__________________
Цели занятия
-
Образовательная- усвоить основные понятия и закономерности комплексных соединении. Теория Вернера.
-
Воспитательная- формирование у обучающихся свойств: дисциплины и ответственности в работе, чуткости и внимания, умение аргументировано отстаивать свою точку зрения и принимать мнение других.
-
Развивающая- развитие у обучающихся самостоятельности принятия решений, аналитического мышления, профессиональных навыков.
2.1 Перечень профессиональных умений, которыми овладеют обучающиеся в процессе учебного занятия формирование мировоззренческих понятий: о познаваемости природы, причинно – следственной зависимости между составом и свойствами соединений.
3.1 Учебно-методическое оснащение, справочная литература Патсаев А.К., Мамытова В.К. "Неорганическая химия", издательство "Эверо", 2012г.
3.2 Техническое оснащение, материалы Периодическая система Д.И.Менделеева, таблица растворимости солей и оснований в воде, таблица ряда электроотрицательности и ряд анионов, таблица классификации химических реакции по типам и видам, таблица закономерности течения химических реакции, таблица химии металлов и неметаллов.
презентация к теме урока, образовательная платформа ZOOM, карточки
4. Ход занятия
Орг момент. Преподаватель проверяет готовность аудитории, кабинет и группы к занятию, отмечает отсутствующих, знакомит с целью занятия.
Актуализация опорных знаний
-
Что такое растворы?
-
Виды растворов
-
Концентрации растворов
-
Молярная концентрация
-
Нормальная концентрация
-
Насыщенные растворы
-
Ненасыщенные растворы
-
Пересыщенные растворы
-
Что такое осмос
-
Осмотическое давление
-
Изотонические растворы
-
Гипертонические растворы
-
Гипотонические растворы
К раствору сульфата калия массой 200 г с массовой долей 8% добавили 6 г этой же соли. После насыщения раствора при 20 ͦ С масса осадка уменьшилась до 1,58 г. Рассчитайте коэффициент растворимости.
Изложение нового материала
Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1893).
Основные положения теории Вернера. Комплексное соединение состоит из центрального атома металла – комплексообразователя М, с которым связаны лиганды L. B состав комплексных соединений входят металлы и неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; она не меняется при образовании комплексного соединения из простых веществ. Выделяют комплексы:
одноядерный ( моноядерный ) – содержит только один атом металла-комплексообразователя, например комплекс [PdCl4]2 имеет один центральный атом- атом палладия (II);
многоядерный ( полиядерный – биядерный, триядерный и т. д.)- содержит два (или более) атома центрального металла, например комплекс [Pt2(NH3)2Cl2] имеет два атома платины (II)- биядерный.
Комплекс означает центральный атом или ион металла, окруженный набором лигандов.
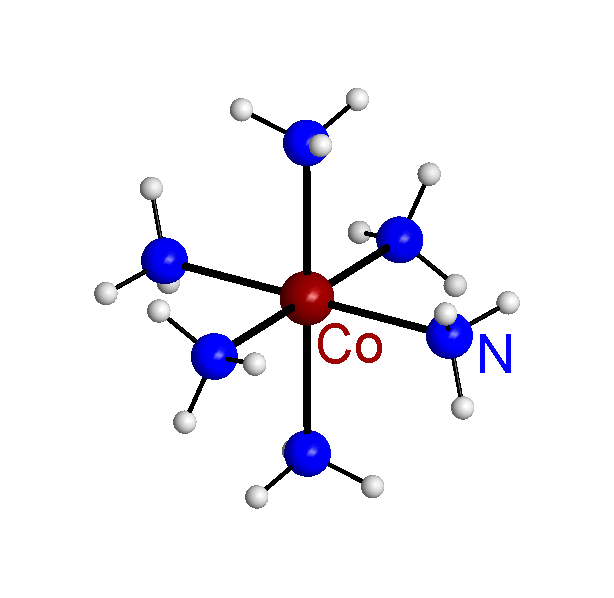
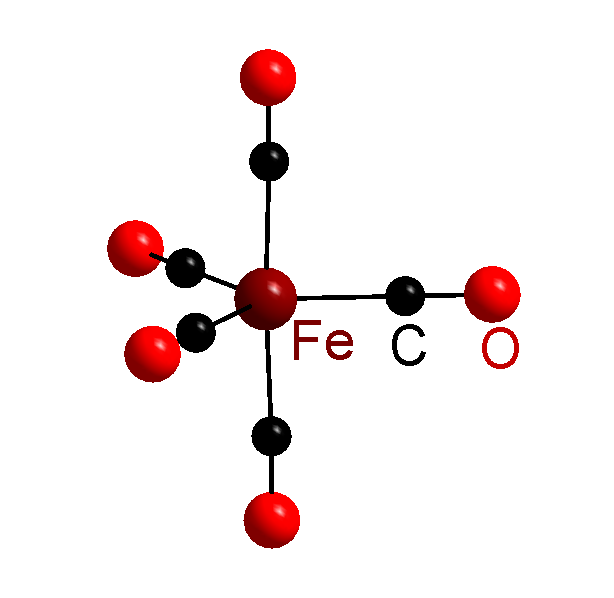
[Co(NH3)6]3+ - комплекс
[Co(NH3)6]Cl3 – комплексное соединение (соль).
[Fe(CO)5] – комплекс и комплексное соединение
Строение комплексного соединения
Внешняя
С![]()
 фера
Внутренняя сфера
фера
Внутренняя сфера
![]()

![]() K3 [Fe(CN)6]
K3 [Fe(CN)6]
Координационное
число
Ион-комплексообразователь Лиганды (центральный атом)
Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от комплекса.
Донорный атом – атом в лиганде, который непосредственно связан с центральным атомом.
Координационное число (КЧ) – число донорных атомов, которые связаны с центральным атомом.


[Co(NH3)6]3+ [Fe(CO)5]
Донорно-акцепторный механизм: лиганд предоставляет электронную пару (основание Льюиса), а центральный атом вакантную орбиталь (кислота Льюиса).
Координационные (комплексные) соединения характерны прежде всего для d- элементов (а также f – элементов) – есть вакантные орбитали металла и они способны принимать электронную пару от лиганда.
Примеры лигандов
Анионы бескислородных кислот
F-, Cl-, Br-, I- (фторо-лиганд и т.д.)
Пример: K2[HgI4] – тетраиодомеркурат(II) калия
Донорный атом O
Остатки кислородсодержащих кислот
CH3COO- - ацетато-лиганд
CO32- - карбонато-лиганд
C2O42- - оксалато-лиганд
SO42- - сульфато-лиганд
Пример: K3[Fe(C2O4)3] –
триоксалатоферрат(III) калия
Донорный атом O
OH- - гидроксо-лиганд
O2- - оксо-лиганд
O22- - пероксо-лиганд
K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
Электоронейтральные молекулы с донорными атомами O: H2O – аква-лиганд
[Fe(H2O)6](ClO4)3 – перхлорат гексаакважелеза(III)
Полидентатные лиганды (dentis – лат. «зуб»)– содержат несколько донорных атомов и занимают несколько позиций в координационной сфере.
Полидентатные лиганды часто образуют хелаты (от греч. «клешня») – комплексы, в которых лиганд и центральный атом образуют цикл.
ИзомерияКС
Геометрическая
изомерия
Ионизационная изомерия
Лиганды во внутренней и внешней координационной сфере меняются местами.
[Co(NH3)5Cl]CN – пентаамминхлорокобальт (II) цианид
[Co(NH3)5СN]Cl – пентаамминцианокобальт (II) хлорид
Частный случай ионизационной изомерии – гидратная изомерия
CrCl3.6H2O – три изомера (различные химические свойства)
|
Соединение |
Цвет |
|
[Cr(H2O)6]Cl3 |
Фиолетовый |
|
[Cr(H2O)5Cl]Cl2.H2O |
Светло-зеленый |
|
[Cr(H2O)4Cl2]Cl.2H2O |
Темно-зеленый |
Координационная изомерия
для комплексных солей, в которых и катион и анион являются комплексными
(CuPt (NH3)4Cl4)
[Cu(NH3)4][PtCl4] – фиолетовый цвет
тетрахлороплатинат тетрааммина меди(II)
[Pt(NH3)4][CuCl4] – желто-коричневый цвет
тетрахлорокупрат тетрааммина платины(II)
Закрепление нового материала-10 минут
1.Комплексные соединения
2.Координационная теория Вернера
3.Виды комплексных соединении
4.Изомерия комплексных соединении
5.Что такое комплексообразователь?
6.Что такое лиганда?
7. Что такое внутренняя сфера?
8. Что такое внешняя сфера?
9. Что такое координационное число?
Вариант I
1) Комплексные соединения это?
А) Неметалловые соединения
Б) Металловые соединения
С) Самый большой и многочисленный класс неорганических соединений
Д) Отрицательно заряженные анионы
2) Когда началось изучение комплексных соединений?
А) XIX- XX в. Б) XVI-XX в. С) XX-XXI в. Д) XVI-XXI в.
3) Основателем координационной теории комплексных соединений является?
А) Авогадро Амедео Б) Альфред Вернер
С) Вёлер Фридрих Д) Гассенди Пьер
4) К соединениям первого порядка относятся?
А) H2O, NaCl, PCl3 Б) (CH3)2SO4, (AlH3)n, (InH3)n
С)
AgЖүктеу
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Тема: Комплексные соединения.
Тема: Комплексные соединения.
Поурочный план педагога для организаций технического и профессионального, послесреднего образования
Тема 4. Комплексные соединения.
(тема
занятия)
Наименование модуля /дисциплины
_________ химия__________
Подготовил педагог ____________________"__"____________ 20_
года
1. Общие сведения
Курс, группы _________ Лаб-02-20, Лаб-02-21
Тип занятия___________________Теория__________________
Цели занятия
-
Образовательная- усвоить основные понятия и закономерности комплексных соединении. Теория Вернера.
-
Воспитательная- формирование у обучающихся свойств: дисциплины и ответственности в работе, чуткости и внимания, умение аргументировано отстаивать свою точку зрения и принимать мнение других.
-
Развивающая- развитие у обучающихся самостоятельности принятия решений, аналитического мышления, профессиональных навыков.
2.1 Перечень профессиональных умений, которыми овладеют обучающиеся в процессе учебного занятия формирование мировоззренческих понятий: о познаваемости природы, причинно – следственной зависимости между составом и свойствами соединений.
3.1 Учебно-методическое оснащение, справочная литература Патсаев А.К., Мамытова В.К. "Неорганическая химия", издательство "Эверо", 2012г.
3.2 Техническое оснащение, материалы Периодическая система Д.И.Менделеева, таблица растворимости солей и оснований в воде, таблица ряда электроотрицательности и ряд анионов, таблица классификации химических реакции по типам и видам, таблица закономерности течения химических реакции, таблица химии металлов и неметаллов.
презентация к теме урока, образовательная платформа ZOOM, карточки
4. Ход занятия
Орг момент. Преподаватель проверяет готовность аудитории, кабинет и группы к занятию, отмечает отсутствующих, знакомит с целью занятия.
Актуализация опорных знаний
-
Что такое растворы?
-
Виды растворов
-
Концентрации растворов
-
Молярная концентрация
-
Нормальная концентрация
-
Насыщенные растворы
-
Ненасыщенные растворы
-
Пересыщенные растворы
-
Что такое осмос
-
Осмотическое давление
-
Изотонические растворы
-
Гипертонические растворы
-
Гипотонические растворы
К раствору сульфата калия массой 200 г с массовой долей 8% добавили 6 г этой же соли. После насыщения раствора при 20 ͦ С масса осадка уменьшилась до 1,58 г. Рассчитайте коэффициент растворимости.
Изложение нового материала
Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1893).
Основные положения теории Вернера. Комплексное соединение состоит из центрального атома металла – комплексообразователя М, с которым связаны лиганды L. B состав комплексных соединений входят металлы и неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; она не меняется при образовании комплексного соединения из простых веществ. Выделяют комплексы:
одноядерный ( моноядерный ) – содержит только один атом металла-комплексообразователя, например комплекс [PdCl4]2 имеет один центральный атом- атом палладия (II);
многоядерный ( полиядерный – биядерный, триядерный и т. д.)- содержит два (или более) атома центрального металла, например комплекс [Pt2(NH3)2Cl2] имеет два атома платины (II)- биядерный.
Комплекс означает центральный атом или ион металла, окруженный набором лигандов.


[Co(NH3)6]3+ - комплекс
[Co(NH3)6]Cl3 – комплексное соединение (соль).
[Fe(CO)5] – комплекс и комплексное соединение
Строение комплексного соединения
Внешняя
С![]()
 фера
Внутренняя сфера
фера
Внутренняя сфера
![]()

![]() K3 [Fe(CN)6]
K3 [Fe(CN)6]
Координационное
число
Ион-комплексообразователь Лиганды (центральный атом)
Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от комплекса.
Донорный атом – атом в лиганде, который непосредственно связан с центральным атомом.
Координационное число (КЧ) – число донорных атомов, которые связаны с центральным атомом.


[Co(NH3)6]3+ [Fe(CO)5]
Донорно-акцепторный механизм: лиганд предоставляет электронную пару (основание Льюиса), а центральный атом вакантную орбиталь (кислота Льюиса).
Координационные (комплексные) соединения характерны прежде всего для d- элементов (а также f – элементов) – есть вакантные орбитали металла и они способны принимать электронную пару от лиганда.
Примеры лигандов
Анионы бескислородных кислот
F-, Cl-, Br-, I- (фторо-лиганд и т.д.)
Пример: K2[HgI4] – тетраиодомеркурат(II) калия
Донорный атом O
Остатки кислородсодержащих кислот
CH3COO- - ацетато-лиганд
CO32- - карбонато-лиганд
C2O42- - оксалато-лиганд
SO42- - сульфато-лиганд
Пример: K3[Fe(C2O4)3] –
триоксалатоферрат(III) калия
Донорный атом O
OH- - гидроксо-лиганд
O2- - оксо-лиганд
O22- - пероксо-лиганд
K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
Электоронейтральные молекулы с донорными атомами O: H2O – аква-лиганд
[Fe(H2O)6](ClO4)3 – перхлорат гексаакважелеза(III)
Полидентатные лиганды (dentis – лат. «зуб»)– содержат несколько донорных атомов и занимают несколько позиций в координационной сфере.
Полидентатные лиганды часто образуют хелаты (от греч. «клешня») – комплексы, в которых лиганд и центральный атом образуют цикл.
ИзомерияКС
Геометрическая
изомерия
Ионизационная изомерия
Лиганды во внутренней и внешней координационной сфере меняются местами.
[Co(NH3)5Cl]CN – пентаамминхлорокобальт (II) цианид
[Co(NH3)5СN]Cl – пентаамминцианокобальт (II) хлорид
Частный случай ионизационной изомерии – гидратная изомерия
CrCl3.6H2O – три изомера (различные химические свойства)
|
Соединение |
Цвет |
|
[Cr(H2O)6]Cl3 |
Фиолетовый |
|
[Cr(H2O)5Cl]Cl2.H2O |
Светло-зеленый |
|
[Cr(H2O)4Cl2]Cl.2H2O |
Темно-зеленый |
Координационная изомерия
для комплексных солей, в которых и катион и анион являются комплексными
(CuPt (NH3)4Cl4)
[Cu(NH3)4][PtCl4] – фиолетовый цвет
тетрахлороплатинат тетрааммина меди(II)
[Pt(NH3)4][CuCl4] – желто-коричневый цвет
тетрахлорокупрат тетрааммина платины(II)
Закрепление нового материала-10 минут
1.Комплексные соединения
2.Координационная теория Вернера
3.Виды комплексных соединении
4.Изомерия комплексных соединении
5.Что такое комплексообразователь?
6.Что такое лиганда?
7. Что такое внутренняя сфера?
8. Что такое внешняя сфера?
9. Что такое координационное число?
Вариант I
1) Комплексные соединения это?
А) Неметалловые соединения
Б) Металловые соединения
С) Самый большой и многочисленный класс неорганических соединений
Д) Отрицательно заряженные анионы
2) Когда началось изучение комплексных соединений?
А) XIX- XX в. Б) XVI-XX в. С) XX-XXI в. Д) XVI-XXI в.
3) Основателем координационной теории комплексных соединений является?
А) Авогадро Амедео Б) Альфред Вернер
С) Вёлер Фридрих Д) Гассенди Пьер
4) К соединениям первого порядка относятся?
А) H2O, NaCl, PCl3 Б) (CH3)2SO4, (AlH3)n, (InH3)n
С)
Ag

шағым қалдыра аласыз















