0 / 1
Барлық 400 000 материалдарды тегін жүктеу үшін
Ұнаған тарифті таңдаңыз
Айлық
Жылдық
1 - күндік
Танысу 690 ₸ / 1 күнге
Таңдау
UstazTilegi AI - ЖИ арқылы тегін ҚМЖ, БЖБ, ТЖБ, тест, презентация, авторлық бағдарлама т.б. 10 материал жасау
Материалдар бөлімі - Барлық 400 000 материалдарды тегін 30 материал жүктеу
Аттестация ПББ тестеріне доступ аласыз шексіз
Көрнекілік бөлімі - 10 000 астам көрнекіліктерді жүктеу Күніне 2 көрнекілік жүктеу
Жеке ҚМЖ бөлімінде - дайын ҚМЖ-ларды, презентацияларды жүктеу5 файлды тегін жүктеу
Олимпиада, турнир, байқауларға 50% жеңілдік
1 - айлық
Стандарт
2990 ₸ / айына
UstazTilegi AI - ЖИ арқылы тегін ҚМЖ, БЖБ, ТЖБ, тест, презентация, авторлық бағдарлама т.б. жасау 30 материал жасау
Материалдар бөлімі - Барлық 400 000 материалдарды тегін 900 материал жүктеу
Аттестация ПББ тестеріне доступ аласыз шексіз
Көрнекілік бөлімі - 10 000 астам көрнекіліктерді жүктеу30 көрнекілік жүктеу
Жеке ҚМЖ бөлімінде - дайын ҚМЖ-ларды, презентацияларды жүктеу 150 файлды тегін жүктеу
Жинақталған ҚМЖ бөлімінде 10 файлды тегін жүктеу
Олимпиада, турнир, байқауларға 50% жеңілдік
Іс-шаралар (мини-курстар, семинарлар, конференциялар) тегін қатысу
1 - айлық
Шебер 7990 ₸ / айына
Таңдау
UstazTilegi AI - ЖИ арқылы тегін ҚМЖ, БЖБ, ТЖБ, тест, презентация, авторлық бағдарлама т.б. жасау 150 материал жасау
Материалдар бөлімі - Барлық 400 000 материалдарды тегін 900 материал жүктеу
Аттестация ПББ тестеріне доступ аласыз шексіз
Көрнекілік бөлімі - 10 000 астам көрнекіліктерді жүктеу90 көрнекілік жүктеу
Жеке ҚМЖ бөлімінде - дайын ҚМЖ-ларды, презентацияларды жүктеу 300 файлды тегін жүктеу
Жинақталған ҚМЖ бөлімінде 50 файлды тегін жүктеу
Олимпиада, турнир, байқауларға 50% жеңілдік
Іс-шаралар (мини-курстар, семинарлар, конференциялар) тегін қатысу

Назар аударыңыз!
Сіз барлық мүмкіндікті қолдандыңыз.
Қалған материалдарды ертең жүктей аласыз.
Ок
Материалдың қысқаша нұсқасы
бегенаева А.Т.,87778303989
ЖИ арқылы жасау
ЖИ арқылы жасау
Бөлісу
1 - айлық
Материал тарифі-96% жеңілдік
00
05
00
ҚМЖ
Ашық сабақ
Тәрбие сағаты
Презентация
БЖБ, ТЖБ тесттер
Көрнекіліктер
Балабақшаға арнарлған құжаттар
Мақала, Эссе
Дидактикалық ойындар
және тағы басқа 400 000 материал
Барлық 400 000 материалдарды шексіз
жүктеу мүмкіндігіне ие боласыз
жүктеу мүмкіндігіне ие боласыз
1 990 ₸ 49 000₸
1 айға қосылу
Материалға шағымдану
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Жариялаған:
Сбоева Владислава ВладимировнаШағым жылдам қаралу үшін барынша толық ақпарат жіберіңіз
Урок по биологии 11 класс. Сравнение сперматогенеза и овогенеза.
Тақырып бойынша 11 материал табылды
Урок по биологии 11 класс. Сравнение сперматогенеза и овогенеза.
Материал туралы қысқаша түсінік
урок составлен согласно требованиям по 130 приказу
Материалдың қысқаша нұсқасы
бегенаева А.Т.,87778303989
Бөлісу
ЖИ арқылы жасау
Файл форматы:

docx
03.12.2023
367
ЖИ арқылы жасау
Жариялаған:
Бұл материалды қолданушы жариялаған. Ustaz Tilegi ақпаратты жеткізуші ғана болып табылады. Жарияланған материалдың мазмұны мен авторлық құқық толықтай автордың жауапкершілігінде. Егер материал авторлық құқықты бұзады немесе сайттан алынуы тиіс деп есептесеңіз,
шағым қалдыра аласыз
шағым қалдыра аласыз



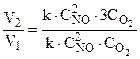 =3.
=3.