|
Мұғалімнің аты-жөні: |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Пән/Сынып: |
Химия, 8 сынып |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Қай аптаның нешінші сабағы |
2- тоқсан 1-сабақ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Тарау немесе бөлім атауы: |
4 тарау. Зат мөлшері |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақтың тақырыбы: |
Зат мөлшері. Моль. Авогадро саны. Заттардың молярлық массасы |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Оқу мақсаты: |
8.1.1.1 –зат мөлшерінің өлшем бірлігі ретінде – мольді білу және Авогадро санын білу; 8.1.1.2 –қосылыстың молярлық массасын есептей алу. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Бағалау критериі: |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Саралап оқыту тапсырмалары |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ұжымдық жұмыс Жаңа тақырыптың түсіндірілуі Сабақ мақсаты мен бағалау критерийлерін таныстыру; Бейнероликті қолдана отырып, бекіту тапсырмаларын орындату. |
Бірлескен жұмыс (1,2 тапсырма) Тапсырманы ұсыну және дұрыс жауапты ұсыну арқылы үйрету; Бекітуге арналғантапсырмаларды орындату; тапсырмалардың жауаптарын жазу. |
Жеке жұмыс Тапсырманы ұсыну, оқушылар өз бетімен орындауы |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Уақыты |
Кезеңдері |
Тапсырма |
Тапсырманың мақсаты |
Мұғалімнің бақылауы мен зерттеуі не? |
Бағалау |
Ресурстар |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 минут 00:00 – 03:00 |
Ұйымдастыру |
Сәлеметсіздерме! Бүгінгі сабағымыздың тақырыбы: Зат мөлшері. Моль. Авогадро саны. Молдік масса Бүгінгі сабақта меңгеретіндеріңіз:
Тірек ұғымдар: Зат мөлшері Моль Авогадро саны Құрылымдық бөлшектер саны Мольдік масса |
|
|
|
Презентация Слайд 2-3 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
8 минут 03:00 – 11:00 11:00-14:00 |
Жаңа сабақ |
Адамдар әртүрлі жағдайда түрлі өлшем бірліктерін қолданады. Мысалы , адамның бойын сантиметрмен өлшесе,қалалардың арасын сантиметрмен емес немесе миллиметрмен емес километрмен өлшейді. Кейде жеңілдету үшін кішігірім бірліктерді топтастырып біріктіреді. Мысалы: 1000 г – 1 кг 30 күн – 1 ай 100 тиын – 1 теңге 100 жыл – 1 ғасыр Сол сияқты химиктерге де өте кішкентай атомдар мен молекулаларды өлшеуге қолайлы өлшем бірлік қажет болды. Химияда заттың өлшемі ретінде ерекше физикалық шама – зат мөлшері алынады. Зат мөлшері мольмен өрнектеледі. Моль – бұл құрамында 0,012 кг (12 г) көміртекте болатын атомдар санына тең құрылымдық бөлшектер (атомдар, молекулалар, т.б.) болатын заттың мөлшері. Көміртектің әрбір атомының массасын (19,93∙10-27 кг) біле отырып көміртектің 0,012 кг массасында қанша атом (N) болатынын есептеуге болады. N= 0,012 кг / 19,93∙10-27 кг = 6,02∙1023 (атом) 602 000 000 000 000 000 000 000 (немесе 6,02∙1023) құрылымдық бөлшектерді атом, молекула және т.б біріктіріп 1 моль деп атайды. 6,02∙1023 саны итальяндық ғалым Амадео Авогадроның құрметіне (1,2-видео): Авогадро саны деп аталады. Белгісі NА, өлшем бірлігі моль -1. (2-видео): NА = 6,02∙1023 моль -1. Ол кез келген заттың 1 молінде 6,02∙1023 бөлшектер болатынын көрсетеді. Мысалы : 1 моль суда да, 1 моль темірде де бөлшектер саны бірдей, тек судың 1 молінде 6,02∙1023 молекула болса, темірдің 1 молінде 6,02∙1023 атом бар. Авогадро санын заттың молекуласын табу үшін қолданады. Зат мөлшерінің формуласы: n = N / NА Зат мөлшері белгілі болса бөлшектер санын анықтауға болады. Молекуланы (N) әрпімен белгілейді. Ол Авогадро санын зат мөлшеріне көбейткенге тең. N = n ∙NА мұндағы : n - зат мөлшері N – молекула немесе атом саны NА - Авогадро саны
Мольдік масса - заттың бір молінің массасы. М әрпімен белгілейді және өлшем бірлігі г/ моль Мольдік масса мен салыстырмалы молекулалық массаның (немесе атомдық) сандық мәндері бір - біріне сәйкес болады. Метанның CH4 мольдік массасын анықтайық: Mr(CH4) = Ar (C ) + Ar (H) ∙ 4 = 12 + 1∙4 = 16 M(CH4) = 16 г /моль Өлшемінен көрініп тұрғандай ,мольдік масса зат массасының оның мөлшеріне қатынасымен өрнектеледі. M = m / n бұдан моль санын есептеуге болады: n = m / M немесе мол саны мен мольдік массалары бойынша заттың массасын есептеуге болады:
m = n ∙ M Заттың мольдік массасының мәні оның сапалық және сандық құрамымен анықталады, яғни Mr және Ar- ге тәуелді. Сондықтан әртүрлі заттардың моль саны бірдей болса да , массалары түрліше болады. Барлық формулаларды сандық есептер шығару үшін қолданамыз. |
Жаңа тақырыпты меңгеру |
|
|
Презентация Слайд 4 Слайд 4 1-видео (00:20 мин) https://cdn4.bilimland.kz/upload/content/platform_lessons/L_12731/29.mp4 2-видео (2:01мин) https://cdn4.bilimland.kz/upload/content/platform_lessons/L_12731/35.mp4 Слайд 5,6,6,8
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
10 минут 14:00-23:00 |
Бекіту тапсырмасы |
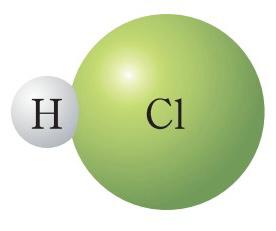
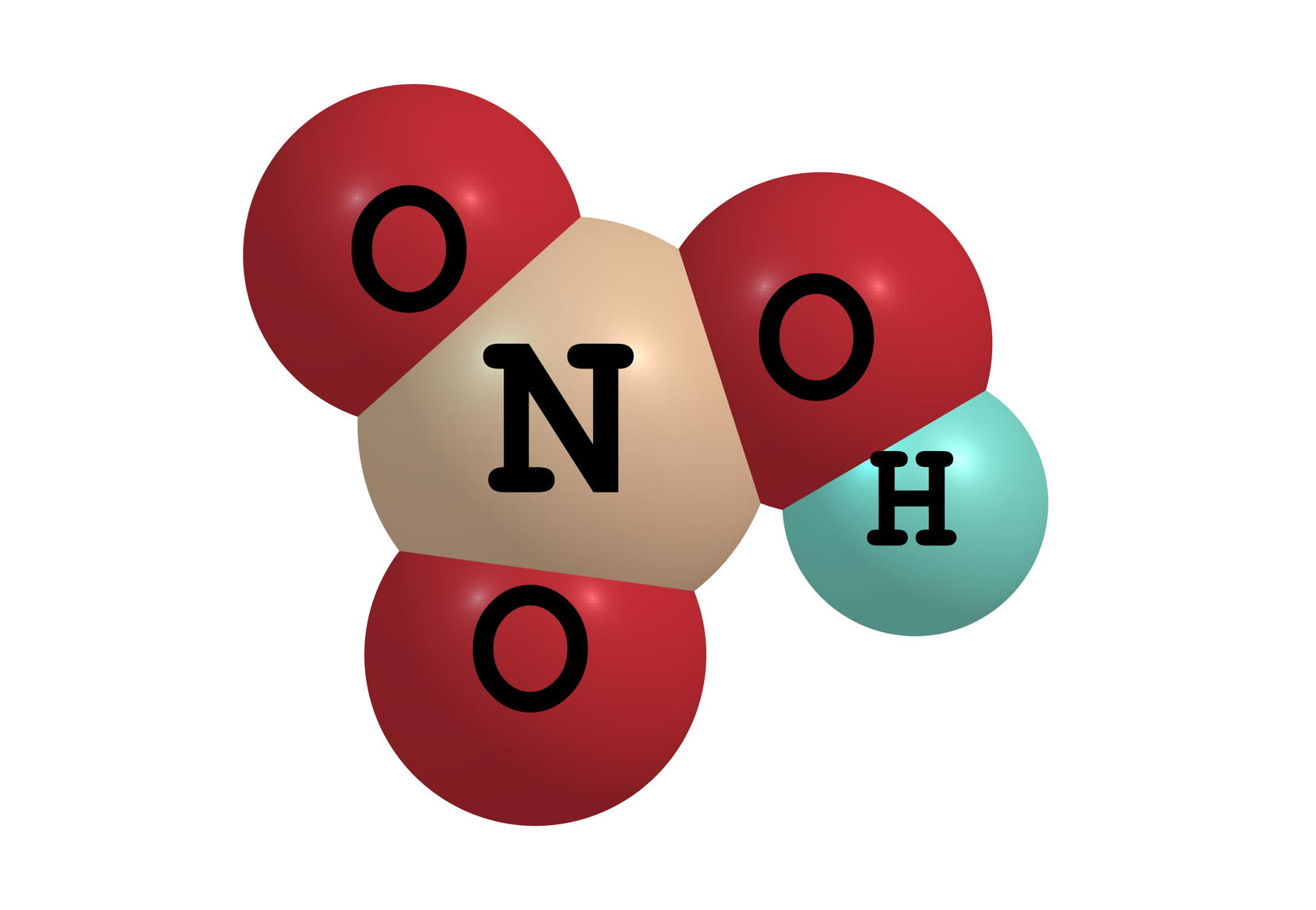
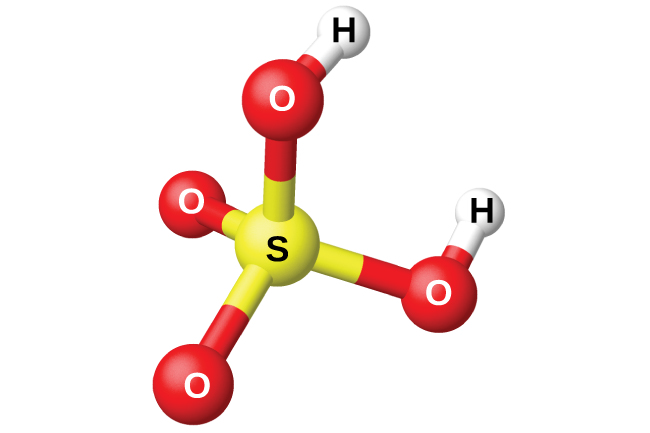
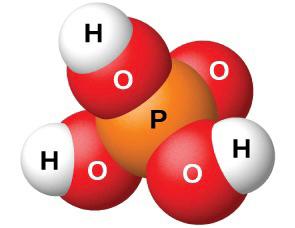
1-тапсырма Төменде хлорсутектің, азот, күкірт және фосфор қышқылдарының молекулаларының модельдері берілген. Олардың формулаларын жазып , мольдік массаларын есептеңдер.
Жауабы: Хлорсутек HCl M(HCl) = Ar(H) + Ar ∙(Cl ) = 1 + 35,5 =36,5 г /моль Азот қышқылы HNO3 M(HNO3) = Ar(H) + Ar ∙(N) + Ar ∙(O) ∙3 = 1 + 14 +48 = 63 г /моль Күкірт қышқылы H2SO4 M(H2SO4) = Ar(H) ∙2 + Ar ∙(S) + Ar ∙(O) ∙4 = 2 + 32 +64 = 98 г /моль Фосфор қышқылы H3PO4 M(H3PO4) = Ar(H) 3 + Ar ∙(P) + Ar ∙(O) ∙4 = 3 + 31 +64 = 98 г /моль 2-тапсырма. Берілген қосылыстардың зат мөлшерін, массасын және молекула сандарын есептеңіз
Жауабы:
|
Жаңа тақырып ты меңгеруге арналған Берілген қосылыс тардың зат мөлшерін, массасын және молекула сандарын есептейді |
|
Дескриптор: Білім алушы - қосылыстардың молекулалық формулаларын жазады
Дескриптор: Білім алушы - қосылыстар дың зат мөлшерін есептейді -қосылыстар дың зат массасын есептейді -қосылыстар дың молекула санын есептейді
|
Презентация Слайд 10 Слайд 11 Слайд 12 Слайд 13-14 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2 минут 23:00-25:00 |
|
Бүгінгі сабақта:
|
Тақырыпты меңгергенін анықтау |
|
|
Презентация Слайд 15 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
жүктеу мүмкіндігіне ие боласыз
Бұл материал сайт қолданушысы жариялаған. Материалдың ішінде жазылған барлық ақпаратқа жауапкершілікті жариялаған қолданушы жауап береді. Ұстаз тілегі тек ақпаратты таратуға қолдау көрсетеді. Егер материал сіздің авторлық құқығыңызды бұзған болса немесе басқа да себептермен сайттан өшіру керек деп ойласаңыз осында жазыңыз
Зат мөлшері. Моль
Зат мөлшері. Моль
|
Мұғалімнің аты-жөні: |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Пән/Сынып: |
Химия, 8 сынып |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Қай аптаның нешінші сабағы |
2- тоқсан 1-сабақ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Тарау немесе бөлім атауы: |
4 тарау. Зат мөлшері |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Сабақтың тақырыбы: |
Зат мөлшері. Моль. Авогадро саны. Заттардың молярлық массасы |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Оқу мақсаты: |
8.1.1.1 –зат мөлшерінің өлшем бірлігі ретінде – мольді білу және Авогадро санын білу; 8.1.1.2 –қосылыстың молярлық массасын есептей алу. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Бағалау критериі: |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Саралап оқыту тапсырмалары |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ұжымдық жұмыс Жаңа тақырыптың түсіндірілуі Сабақ мақсаты мен бағалау критерийлерін таныстыру; Бейнероликті қолдана отырып, бекіту тапсырмаларын орындату. |
Бірлескен жұмыс (1,2 тапсырма) Тапсырманы ұсыну және дұрыс жауапты ұсыну арқылы үйрету; Бекітуге арналғантапсырмаларды орындату; тапсырмалардың жауаптарын жазу. |
Жеке жұмыс Тапсырманы ұсыну, оқушылар өз бетімен орындауы |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Уақыты |
Кезеңдері |
Тапсырма |
Тапсырманың мақсаты |
Мұғалімнің бақылауы мен зерттеуі не? |
Бағалау |
Ресурстар |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 минут 00:00 – 03:00 |
Ұйымдастыру |
Сәлеметсіздерме! Бүгінгі сабағымыздың тақырыбы: Зат мөлшері. Моль. Авогадро саны. Молдік масса Бүгінгі сабақта меңгеретіндеріңіз:
Тірек ұғымдар: Зат мөлшері Моль Авогадро саны Құрылымдық бөлшектер саны Мольдік масса |
|
|
|
Презентация Слайд 2-3 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
8 минут 03:00 – 11:00 11:00-14:00 |
Жаңа сабақ |
Адамдар әртүрлі жағдайда түрлі өлшем бірліктерін қолданады. Мысалы , адамның бойын сантиметрмен өлшесе,қалалардың арасын сантиметрмен емес немесе миллиметрмен емес километрмен өлшейді. Кейде жеңілдету үшін кішігірім бірліктерді топтастырып біріктіреді. Мысалы: 1000 г – 1 кг 30 күн – 1 ай 100 тиын – 1 теңге 100 жыл – 1 ғасыр Сол сияқты химиктерге де өте кішкентай атомдар мен молекулаларды өлшеуге қолайлы өлшем бірлік қажет болды. Химияда заттың өлшемі ретінде ерекше физикалық шама – зат мөлшері алынады. Зат мөлшері мольмен өрнектеледі. Моль – бұл құрамында 0,012 кг (12 г) көміртекте болатын атомдар санына тең құрылымдық бөлшектер (атомдар, молекулалар, т.б.) болатын заттың мөлшері. Көміртектің әрбір атомының массасын (19,93∙10-27 кг) біле отырып көміртектің 0,012 кг массасында қанша атом (N) болатынын есептеуге болады. N= 0,012 кг / 19,93∙10-27 кг = 6,02∙1023 (атом) 602 000 000 000 000 000 000 000 (немесе 6,02∙1023) құрылымдық бөлшектерді атом, молекула және т.б біріктіріп 1 моль деп атайды. 6,02∙1023 саны итальяндық ғалым Амадео Авогадроның құрметіне (1,2-видео): Авогадро саны деп аталады. Белгісі NА, өлшем бірлігі моль -1. (2-видео): NА = 6,02∙1023 моль -1. Ол кез келген заттың 1 молінде 6,02∙1023 бөлшектер болатынын көрсетеді. Мысалы : 1 моль суда да, 1 моль темірде де бөлшектер саны бірдей, тек судың 1 молінде 6,02∙1023 молекула болса, темірдің 1 молінде 6,02∙1023 атом бар. Авогадро санын заттың молекуласын табу үшін қолданады. Зат мөлшерінің формуласы: n = N / NА Зат мөлшері белгілі болса бөлшектер санын анықтауға болады. Молекуланы (N) әрпімен белгілейді. Ол Авогадро санын зат мөлшеріне көбейткенге тең. N = n ∙NА мұндағы : n - зат мөлшері N – молекула немесе атом саны NА - Авогадро саны
Мольдік масса - заттың бір молінің массасы. М әрпімен белгілейді және өлшем бірлігі г/ моль Мольдік масса мен салыстырмалы молекулалық массаның (немесе атомдық) сандық мәндері бір - біріне сәйкес болады. Метанның CH4 мольдік массасын анықтайық: Mr(CH4) = Ar (C ) + Ar (H) ∙ 4 = 12 + 1∙4 = 16 M(CH4) = 16 г /моль Өлшемінен көрініп тұрғандай ,мольдік масса зат массасының оның мөлшеріне қатынасымен өрнектеледі. M = m / n бұдан моль санын есептеуге болады: n = m / M немесе мол саны мен мольдік массалары бойынша заттың массасын есептеуге болады:
m = n ∙ M Заттың мольдік массасының мәні оның сапалық және сандық құрамымен анықталады, яғни Mr және Ar- ге тәуелді. Сондықтан әртүрлі заттардың моль саны бірдей болса да , массалары түрліше болады. Барлық формулаларды сандық есептер шығару үшін қолданамыз. |
Жаңа тақырыпты меңгеру |
|
|
Презентация Слайд 4 Слайд 4 1-видео (00:20 мин) https://cdn4.bilimland.kz/upload/content/platform_lessons/L_12731/29.mp4 2-видео (2:01мин) https://cdn4.bilimland.kz/upload/content/platform_lessons/L_12731/35.mp4 Слайд 5,6,6,8
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
10 минут 14:00-23:00 |
Бекіту тапсырмасы |
1-тапсырма Төменде хлорсутектің, азот, күкірт және фосфор қышқылдарының молекулаларының модельдері берілген. Олардың формулаларын жазып , мольдік массаларын есептеңдер.
Жауабы: Хлорсутек HCl M(HCl) = Ar(H) + Ar ∙(Cl ) = 1 + 35,5 =36,5 г /моль Азот қышқылы HNO3 M(HNO3) = Ar(H) + Ar ∙(N) + Ar ∙(O) ∙3 = 1 + 14 +48 = 63 г /моль Күкірт қышқылы H2SO4 M(H2SO4) = Ar(H) ∙2 + Ar ∙(S) + Ar ∙(O) ∙4 = 2 + 32 +64 = 98 г /моль Фосфор қышқылы H3PO4 M(H3PO4) = Ar(H) 3 + Ar ∙(P) + Ar ∙(O) ∙4 = 3 + 31 +64 = 98 г /моль 2-тапсырма. Берілген қосылыстардың зат мөлшерін, массасын және молекула сандарын есептеңіз
Жауабы:
|
Жаңа тақырып ты меңгеруге арналған Берілген қосылыс тардың зат мөлшерін, массасын және молекула сандарын есептейді |
|
Дескриптор: Білім алушы - қосылыстардың молекулалық формулаларын жазады
Дескриптор: Білім алушы - қосылыстар дың зат мөлшерін есептейді -қосылыстар дың зат массасын есептейді -қосылыстар дың молекула санын есептейді
|
Презентация Слайд 10 Слайд 11 Слайд 12 Слайд 13-14 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2 минут 23:00-25:00 |
|
Бүгінгі сабақта:
|
Тақырыпты меңгергенін анықтау |
|
|
Презентация Слайд 15 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

шағым қалдыра аласыз